Ver traducción automática
Esta es una traducción automática. Para ver el texto original en inglés haga clic aquí
#Novedades de la industria
Ensayo de curación de heridas - qué, por qué y cómo
BONUS: Descargue el paquete de ensayo de raspado
Ensayo de curación de heridas in vitro, también conocido como ensayo de raspado
El ensayo de cicatrización de heridas, también conocido como ensayo de raspado, es una técnica bidimensional establecida (2D) que puede ser utilizada para investigar la migración colectiva y la cicatrización de heridas in vitro [1], [2]. Este método fue uno de los primeros en desarrollarse para el estudio de la migración celular y mide la velocidad a la que las células, en una monocapa celular, migran para llenar un hueco sin células [1], [3]. Los ensayos de cicatrización de heridas tridimensionales (3D) están fuera del alcance de este artículo y han sido tratados sucintamente por Stamm et al. 2016 [2].
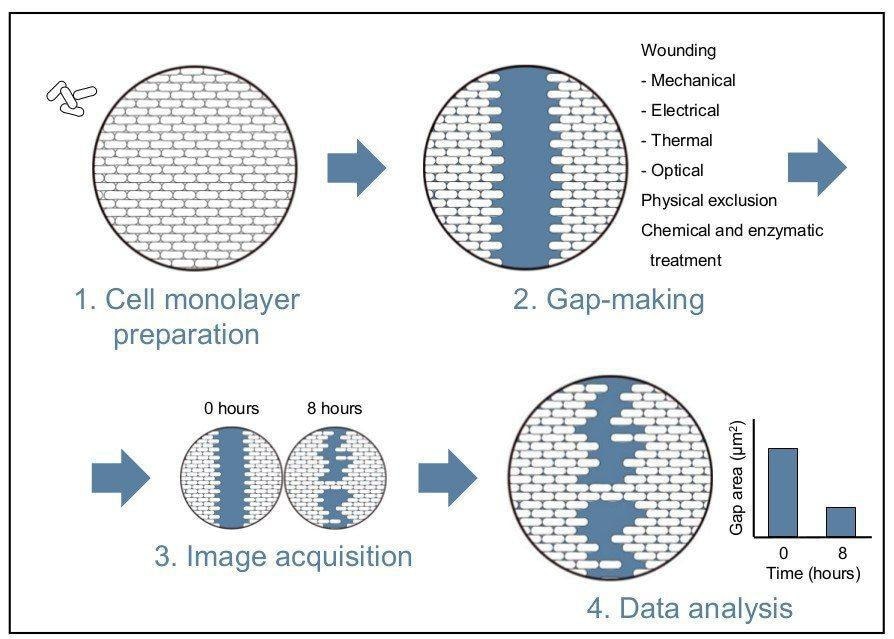
El ensayo de curación de heridas es un método simple y barato. Aunque este ensayo no recapitula las condiciones exactas de una herida, puede aplicarse con éxito para modelar e investigar el movimiento celular en un entorno in vitro controlado. La técnica reproduce la herida creando un hueco en una monocapa celular confluente, y consta de cuatro pasos principales que se detallarán más adelante (véase la figura 1 para una visión general)[1].
Protocolo de ensayo de curación de heridas
Preparación de la cultura
El primer paso del ensayo es cultivar una célula monocapa confluente. Esta monocapa representa las condiciones in vivo del tejido antes de la herida, como un epitelio intacto. A menudo, las células epiteliales y endoteliales se utilizan para producir la monocapa, y en particular, los tipos de células capaces de la migración de la hoja [4]. Los estudios también han examinado la migración de las células del músculo liso vascular [5], [6].
Dependiendo del tipo de célula utilizada en el ensayo, la proliferación celular puede ser un factor de confusión. La proliferación celular puede competir con la migración celular para llenar el hueco hecho durante el ensayo. Si esto ocurre, el medio celular puede ser optimizado para reducir la proliferación celular. La disminución de la concentración de suero (inanición de suero) es el cambio más común. Los inhibidores de la proliferación, como la mitomicina C, también pueden añadirse al medio. Es necesaria una cuidadosa optimización ya que cualquier cambio en el medio puede resultar en efectos impredecibles dependientes del tiempo y del tipo de célula que pueden interferir en el ensayo [1].
Raspado
Después de que las células se han vuelto confluentes, el siguiente paso es hacer un hueco sin células en la monocapa. El método más utilizado es el de enrollar la monocapa mediante un raspado mecánico (scratch wound) o un estampado. Las alternativas al daño mecánico pueden incluir heridas térmicas, eléctricas y ópticas [2], [7]. En los ensayos de curación de heridas con microfluidos, se han utilizado tratamientos químicos y enzimáticos para limpiar las células de los canales de fluidos [5], [6], [8], [9]. También se han descrito métodos que evitan por completo el daño celular, como la exclusión física [4], [10].
La preparación de las lagunas puede realizarse manualmente o de forma automatizada. Los inconvenientes del método manual son el bajo rendimiento y la variación del ancho de la brecha entre los pozos [1], [11]. Esta reproducibilidad puede mejorarse con el uso de herramientas comerciales para hacer huecos uniformes [1]. Las modificaciones del ensayo de cicatrización de heridas que utilizan la automatización pueden aumentar tanto el rendimiento como mejorar la reproducibilidad [2], [7]. Asegurar la reproducibilidad es importante para el siguiente paso de adquisición de datos.
Adquisición de datos - imágenes de arañazos para el lapso de tiempo
Con una brecha sin células preparada, la microscopía óptica puede ser usada para observar las células que migran al área de la herida. La migración de las células se ve mejor usando imágenes con contraste de fase en lugar de fluorescencia, y el área de la herida en el campo de visión debe ser maximizada usando la lente objetivo [12] [13].
Una vez que el microscopio está configurado, se puede adquirir una serie de imágenes en un lapso de tiempo (método de instantáneas) a medida que las células migran hacia la brecha libre de células [1]. Estos puntos de tiempo deben ser recogidos dentro de las 24 horas de iniciado el experimento para minimizar los efectos confusos de la replicación celular en el cierre de la brecha. Las imágenes de la migración pueden entonces ser usadas para recoger medidas o anotadas visualmente [4]. Se pueden obtener manualmente mediciones precisas utilizando una cámara digital instalada en el microscopio; sin embargo, este proceso requiere mucho tiempo y mantener el mismo campo de visión a lo largo de cada brecha puede ser difícil [4].
Las desventajas experimentadas con la adquisición manual pueden superarse en gran medida utilizando la automatización que permite la obtención de imágenes de células vivas. Los aspectos de la adquisición que pueden ser automatizados incluyen: la captura de imágenes, la visita de puntos y el control del entorno [2], [4]. La automatización también tiene una mayor funcionalidad, por ejemplo, puede utilizarse para determinar los puntos finales experimentales y generar mediciones cinéticas, funcionales y cuantitativas de células vivas (véase la figura 2) [1].
Los sistemas de imágenes de pozo entero pueden aplicarse al ensayo de curación de la herida. Para los investigadores interesados en tal funcionalidad, ver la página de aterrizaje de CytomSMART Omni. Este sistema de imágenes de células vivas opera desde el interior de incubadoras de cultivos celulares y está totalmente automatizado, para crear fácilmente videos en intervalos de tiempo de cierre de brechas.
Análisis de datos - cierre de raspado
Una vez que se han adquirido imágenes del cierre de la brecha, se pueden utilizar varios métodos de análisis para cuantificar la tasa de migración celular. El primer método mide el cambio en el ancho de la herida (nanómetros) a lo largo del tiempo. Este ancho es la distancia media entre los dos márgenes del rasguño. El segundo método calcula el cambio en el área de la herida a lo largo del tiempo como un porcentaje del cierre de la misma. Estos dos métodos pueden llevar mucho tiempo cuando se realizan manualmente. El último método mide la densidad relativa de la herida a lo largo del tiempo expresada en porcentaje y se aplica con mayor frecuencia en los programas de imágenes de células vivas [1], [12]. Este método calcula la relación entre el área ocupada en la brecha y el área total de la brecha inicial. El método de densidad relativa de las heridas puede refinarse aún más para tener en cuenta la proliferación celular o los efectos farmacológicos. Esto puede lograrse contando las células de las subregiones que se encuentran dentro y fuera de la zona de la herida para determinar la densidad celular relativa [12]. El recuento total de células dentro de la zona de la herida también puede utilizarse para evaluar la migración celular y la cicatrización de la herida [2].
Además de medir los cambios en el área de la herida, el ensayo de cicatrización de la herida también puede aplicarse para rastrear el movimiento de las células individuales en el borde anterior de la herida. Esto permite a los investigadores la oportunidad de entender el papel de los genes en la regulación de la migración celular [3].
La mayoría de los ensayos de curación de heridas todavía utilizan en parte la adquisición y el análisis manual de datos. La extracción manual de datos es muy lenta, subjetiva y propensa a errores. Por lo tanto, el análisis de grandes conjuntos de datos sigue siendo un cuello de botella con muchos ensayos. Además, la multitud de ensayos disponibles dificulta la comparación entre los experimentos [2]. Se han desarrollado programas de análisis de datos automatizados, como TScratch e ImageJ, que pueden acelerar significativamente el análisis y superar las limitaciones asociadas a la calidad de la imagen [14], [15].
Para conocer las directrices de los ensayos de cicatrización de heridas en profundidad sobre los parámetros para asegurar resultados cuantitativos y reproducibles, véase la revisión de Jonkman et al. (2014)[4].
Ensayo de migración celular
El ensayo de cicatrización de heridas se utiliza para investigar la migración celular y la cicatrización de heridas. La migración celular es el movimiento de células individuales, hojas de células y grupos de células de un lugar a otro, y se han identificado dos tipos principales, a saber, la migración de una sola célula y la migración celular colectiva. Esta última es definida por Grada y otros (2016) como el movimiento coordinado de un grupo de células que mantiene sus conexiones intercelulares y su polaridad colectiva [1].
La migración colectiva puede adoptar dos formas diferentes dependiendo de la matriz extracelular. La migración colectiva tridimensional tiene lugar en un andamiaje de tejidos, y es el movimiento de células organizadas en una red multicelular de hebras. La migración colectiva bidimensional (2D) (migración de láminas) tiene lugar a través de la superficie de un tejido, y es el movimiento de láminas planas monocapa. La cicatrización de heridas es un ejemplo de migración de hojas [1].
-----------
Para los investigadores que buscan evaluar los patrones de migración de una sola célula, recomendamos el Kit de Dúo Citomart Lux2. Este sistema de imágenes de células mini-vivas opera desde el interior de incubadoras de cultivos celulares y permite la comparación lado a lado entre los cultivos celulares.
-----------
La curación de las heridas
Cuatro procesos ocurren durante la curación de las heridas, a saber, hemostasia, inflamación, migración-proliferación y maduración-modelación [1], [2]. Tras la lesión y bajo la influencia de los factores de crecimiento y las citoquinas, los queratinocitos de la parte posterior del margen de la herida comienzan a proliferar y a migrar hacia el lecho de la herida. Este proceso implica la migración, proliferación y diferenciación de las células [1].
Se considera que la migración es el proceso que limita la tasa durante la curación y, por lo tanto, los ensayos de migración son una parte clave de la investigación de la curación de las heridas [2].
Aplicaciones del ensayo de curación de heridas
El ensayo de cicatrización de heridas es un método conveniente y económico para investigar la migración celular colectiva en diferentes condiciones experimentales. Dado que la migración celular colectiva está vinculada a muchos procesos fisiológicos y patológicos relacionados con la embriogénesis, la reparación de heridas y la metástasis del cáncer, el ensayo de curación de heridas es ampliamente aplicable [4], [8]. El ensayo puede utilizarse para investigar los efectos de la interacción célula-matriz y célula-célula en la migración celular, y combinarse con la transfección para determinar el efecto de la expresión de genes exógenos en la migración de células individuales [1], [3].
El ensayo también es escalable, lo que permite una detección de alto rendimiento de los genes implicados en la migración de las células cancerosas, el descubrimiento de pequeñas moléculas y el descubrimiento de drogas [1], [2], [16]. A continuación se presentan ejemplos de algunas de estas aplicaciones.
Un ensayo de cicatrización de heridas con microfluidos fue desarrollado por Wei y otros (2015) para investigar la migración de células de músculo liso vascular. La migración de estas células después de una lesión endotelial es un factor inherente a la progresión de la aterosclerosis y las complicaciones asociadas con la hiperplasia íntima [6]. Ambas enfermedades son una causa importante de morbilidad y mortalidad a nivel mundial [17]. La comprensión de los procesos que intervienen en esta migración puede proporcionar objetivos potenciales para la inhibición. Este ensayo de cicatrización modificado es una representación más cercana del microambiente presente en la vasculatura. En el ensayo de cicatrización de heridas microfluídicas del estudio se utilizaron cinco tipos de VSMCs [6].
El ensayo de curación de heridas puede ser usado en el estudio de los apósitos de las heridas. Alves y otros (2020) utilizaron el ensayo para investigar nuevas mezclas de hidrogel como posible apósito para heridas. El efecto del hidrogel en el cierre de la herida se evaluó incorporándolo al medio celular. Los autores demostraron que los hidrogeles podían utilizarse para mejorar el proceso de cicatrización de las heridas promoviendo la migración, adhesión y proliferación de fibroblastos [18].
Los inhibidores de la invasión celular y de la metástasis pueden ser examinados eficazmente usando el ensayo de curación de la herida. Wang y otros examinaron con éxito los alcaloides citotóxicos por su capacidad de inhibir los procesos biológicos relacionados con la migración celular y la dinámica del citoesqueleto. El estudio pudo identificar ciertos alcaloides citotóxicos como agentes antimigratorios que podrían investigarse más a fondo [19].
Autor
Guy Regnard
Tengo una formación en ciencias de la vida con un doctorado en biología molecular y celular. Mi doctorado se centró en un virus animal para entender su genética y desarrollar una vacuna candidata. Mi trabajo se ha centrado en el desarrollo de vacunas de subunidades para detener los virus que afectan a nuestra salud e impactan en nuestra economía. Estos incluyen el VIH, el virus del papiloma humano (que causa el cáncer cervical) y los virus que infectan a las ovejas y los cerdos.
Conozca todas las soluciones de imágenes de CytoSMART en el sitio web oficial de CytoSMART
Referencias
1] A. Grada, M. Otero-Vinas, F. Prieto-Castrillo, Z. Obagi, y V. Falanga, "Técnicas de investigación simplificadas: análisis de la migración celular colectiva mediante el ensayo de curación de heridas", J. Invest. Dermatol., vol. 137, no. 2, pp. e11--e16, 2017.
2] A. Stamm, K. Reimers, S. Strauß, P. Vogt, T. Scheper, e I. Pepelanova, "Ensayos de curación de heridas in vitro - estado del arte", BioNanoMaterials, vol. 17, no. 1-2, pp. 79-87, 2016.
3] L. G. Rodríguez, X. Wu, y J.-L. Guan, "Wound-healing assay", en Cell Migration, Springer, 2005, pp. 23-29.
[4] J. E. N. Jonkman y otros, "Una introducción al ensayo de curación de heridas usando microscopía de células vivas", Cell Adh. Migr., vol. 8, no. 5, pp. 440-451, 2014.
5] A. D. der Meer, K. Vermeul, A. A. Poot, J. Feijen e I. Vermes, "A microfluidic wound-healing assay for quantifying endothelial cell migration", Am. J. Physiol. Circ. Physiol., vol. 298, no. 2, pp. H719--H725, 2010.
6] Y. Wei y otros, "A tubing-free microfluidic wound healing assay enabling the quantification of vascular smooth muscle cell migration", Sci. Rep., vol. 5, pág. 14049, 2015.
C.R. Keese, J. Wegener, S.R. Walker e I. Giaever, "Ensayo de curación de heridas eléctricas para células in vitro", Proc. Acad. Nacional. Sci., vol. 101, no. 6, págs. 1554-1559, 2004.
8] R. Riahi, Y. Yang, D. D. Zhang y P. K. Wong, "Avances en los ensayos de cicatrización de heridas para sondear la migración celular colectiva", J. Lab. Autom., vol. 17, no. 1, págs. 59-65, 2012.
[9] J.-Y. Lin, K.-Y. Lo, y Y.-S. Sun, "Un ensayo de cicatrización de heridas basado en microfluidos para estudiar los efectos de las tensiones de cizallamiento, el ancho de las heridas y los productos químicos en el proceso de cicatrización de heridas", Sci. Rep., vol. 9, no. 1, pp. 1-11, 2019.
10] A. P. Looney y M. Bhattacharya, "Fibroblast Gap-closure Assay-Microscopy-based in vitro Assay Measuring the Migration of Murine Fibroblasts", Bio-protocol, vol. 9, no. 16, 2019.
S. Martinotti y E. Ranzato, "Ensayo de curación de heridas por arañazos", 2019.
12] S. T. Johnston, E. T. Shah, L. K. Chopin, D. L. S. McElwain, y M. J. Simpson, "Estimando la difusividad celular y la tasa de proliferación celular mediante la interpretación de los datos del ensayo ZOOMTM de IncuCyte utilizando el modelo de Fisher-Kolmogorov", BMC Syst. Biol., vol. 9, no. 1, pág. 38, 2015.
13] C. N. Ramírez y otros, "Validación de un ensayo de detección de alto contenido utilizando imágenes de pozo entero de fenotipos transformados", Assay Drug Dev. Technol., vol. 9, no. 3, págs. 247 a 261, 2011.
14] T. Gebäck, M. M. P. Schulz, P. Koumoutsakos y M. Detmar, "TScratch: una novedosa y sencilla herramienta de software para el análisis automatizado de ensayos de curación de heridas de una sola capa: Short Technical Reports", Biotechniques, vol. 46, no. 4, págs. 265 a 274, 2009.
15] K. A. Main, C. M. Mikelis, y C. L. Doçi, "In Vitro Wound Healing Assays to Investigate Epidermal Migration", 2019.
16] J. C. Yarrow, Z. E. Perlman, N. J. Westwood y T. J. Mitchison, "A high-throughput cell migration assay using scratch wound healing, a comparison of image-based readout methods", BMC Biotechnol, vol. 4, Nº 1, pág. 21, 2004.
[17] K. Kobiyama, R. Saigusa y K. Ley, "Vacunación contra la aterosclerosis", Curr. Opinión. Immunol., vol. 59, pp. 15-24, 2019.
18] A. Alves y otros, "Xanthan Gum--Konjac Glucomannan Blend Hydrogel for Wound Healing", Polymers (Basilea), vol. 12, no. 1, pág. 99, 2020.
19] X. Wang, C. C. Decker, L. Zechner, S. Krstin, y M. Wink, "Curación in vitro de células tumorales: inhibición de la migración celular por alcaloides citotóxicos seleccionados", BMC Pharmacol. Toxicol., vol. 20, no. 1, pp. 1-12, 2019.





