Ver traducción automática
Esta es una traducción automática. Para ver el texto original en inglés haga clic aquí
#Novedades de la industria
Guía de aprendizaje de la fotometría de fibra para principiantes
aprender la tecnología de fotometría de fibra
Si está empezando a conocer la tecnología de fotometría de fibra, este artículo le resultará muy útil.
La fotometría de fibra es un método óptico que se basa en el principio de la medición de la luz emitida por las moléculas fluorescentes a través de la fibra óptica basada en el recuento de fotones simples relacionados con el tiempo (TCSPC). A partir de este principio, sabemos que la realización de este experimento requiere herramientas de sondeo que puedan expresar la fluorescencia en el tejido, así como un conjunto de equipos que puedan transmitir la fluorescencia y detectarla.
A continuación, examinamos en primer lugar las herramientas de fluorescencia. Actualmente, las herramientas de fluorescencia más utilizadas se dividen en indicadores de calcio, indicadores de neurotransmisores, indicadores de voltaje, etc. Debido a que hay muchos tipos de modelos animales para aplicaciones experimentales, y también necesitamos estudiar regiones específicas del cerebro o incluso tipos específicos de células, las técnicas de edición de genes han sido ampliamente utilizadas para el desarrollo de sondas.
Los indicadores de calcio codificados genéticamente (GECIs) más comunes son proteínas fluorescentes derivadas de la proteína verde fluorescente (GFP, etc.) y sus variantes (por ejemplo, GFP de disposición circular, YFP, CFP, RFP, etc.) fusionadas a la calmodulina (CaM) y al dominio M13 de la cadena ligera de miosina quinasa. Cuando el Ca2+ está presente, se une a la CaM, lo que lleva a la interacción entre los dominios estructurales M13 y CaM, desencadenando un reordenamiento estructural de la cpEGFP, que aumenta la señal de fluorescencia verde/roja.
Los GECIs más utilizados son: GCaMP, Pericams, Cameleons, TN-XXL y Twitch, entre los cuales GCaMP6, GCaMP7 son ahora ampliamente utilizados en estudios de imagen de calcio in vivo debido a su sensibilidad superior. A continuación se presenta un resumen de los tipos de GECI comunes.
Figura 1
GCaMP6 GCaMP6s Alta sensibilidad, adecuada para señales de baja frecuencia
GCaMP6m Actividad moderada, amplia gama de aplicaciones
GCaMP6f Disociación rápida, adecuada para señales de alta frecuencia
jGCaMP7 jGCaMP7s Alta sensibilidad y mayor rapidez que GCaMP6s
jGCaMP7f Respuesta Df/F mejorada, adecuada para un potencial de acción único o un experimento de actividad de grupo
jGCaMP7b Alto brillo del potencial de reposo, adecuado para neuritis o fibras nerviosas
jGCaMP7c Alto contraste, adecuado para la obtención de imágenes de gran alcance
jRGECO1a jRGECO1a La longitud de onda de excitación está desplazada al rojo y puede utilizarse con GCaMP
jRCaMP1 jRCaMP1a
jRCaMP1b
Axón-GCaMP Axón-GCaMP Marcar el axón
El principio de las sondas de neurotransmisores es similar al anterior, en el que la cpEGFP está incrustada en receptores de neurotransmisores específicos, y la unión de los receptores a los neurotransmisores desencadena un cambio conformacional de los receptores en una señal fluorescente, y los cambios en tiempo real en la concentración de neurotransmisores se pueden observar con la ayuda de técnicas de imagen. Las sondas de neurotransmisores que se han desarrollado incluyen DA (dopamina), Ach (acetilcolina), NE (norepinefrina), 5HT (5-hidroxitriptamina), Ado (adenosina), ATP (trifosfato de adenosina), CCK (colecistoquinina), VIP (péptido intestinal vasoactivo) y eCB (endocannabinoide), etc.
Debido al ciclo de cambio de señal relativamente lento de las señales de calcio, así como de los neurotransmisores, si queremos registrar la señal rápida del potencial de membrana, tenemos que utilizar herramientas relevantes como los indicadores de voltaje codificados genéticamente (GEVI). Los cambios de potencial de membrana son una señal directa tanto de los potenciales sinápticos como de los de acción. En algunos casos, la señal GEVI es más rápida y más informativa que las mediciones con GECI.
Después de entender estos indicadores fluorescentes, tenemos que tener claro cómo expresar los indicadores en el animal. Esta sonda codificada genéticamente puede expresarse en las células o en el cerebro del ratón mediante inyección viral, transfección, cruce de animales y otros medios técnicos. Tomemos como ejemplo el estudio de la inyección estereotáxica en el cerebro: 1. elegir la herramienta de virus adecuada (que contiene la información codificada por el indicador) para inyectarla en un lugar específico; 2. implantar la fibra óptica para transmitir la luz de excitación y recoger la luz de emisión; 3. esperar 2-3 semanas para que el virus se exprese y luego comprobar la señal de fluorescencia.
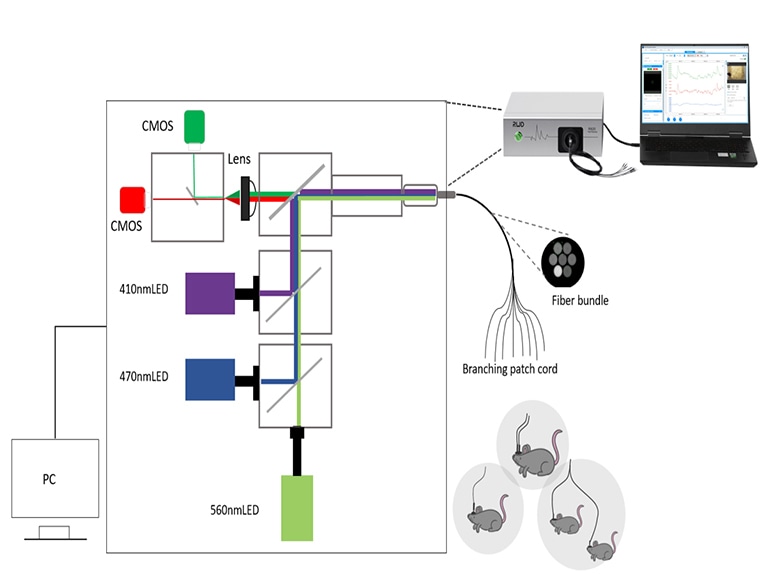
Una vez preparados los animales, es necesario seleccionar un sistema adecuado para recoger y analizar la señal de fluorescencia. Los componentes básicos de un sistema de fotometría de fibra incluyen fuentes de luz de excitación, filtros, espejos dicroicos, detectores y accesorios de fibra óptica.
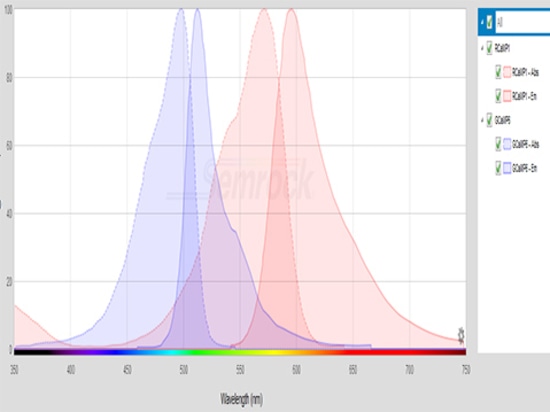
Las longitudes de onda de excitación del GCaMP se concentran entre 450nm-500nm, mientras que las del RCaMP se concentran entre 530nm-580nm. La fuente de luz de excitación necesita ser seleccionada de acuerdo con el rango de longitud de onda de excitación del indicador fluorescente. También es necesario elegir la potencia de excitación adecuada, por ejemplo, 20μW ~ 50μW es más apropiado para GCaMP excitado, si la potencia es demasiado alta, es fácil conducir a la decoloración de la señal o incluso el apagado.
El filtro debe tener en cuenta el rango de longitud de onda de emisión de la proteína fluorescente. La longitud de onda de emisión de la GCaMP se concentra entre 500nm-550nm, mientras que la RCaMP se concentra entre 570nm-630nm.
Hay muchos tipos de fotodetectores, como PMT, CCD, CMOS, fotodiodo, etc. En general, se cree que el PMT (tubo fotomultiplicador) es muy sensible y adecuado para la detección de señales muy débiles, pero sólo para experimentos de un solo canal; el CCD puede utilizarse para el registro multicanal, pero la velocidad de la imagen es lenta; el CMOS tiene un mejor rendimiento de costes y puede utilizarse para el registro multicanal, mientras que la velocidad de procesamiento de la imagen es rápida. El registro experimental multicanal puede utilizar fibra óptica de múltiples ramas, a través de un sistema puede registrar múltiples áreas del cerebro o múltiples cambios de señal de los animales.
Los accesorios de fibra óptica deben seleccionarse con una capa protectora negra y material de baja autofluorescencia para evitar mejor la interferencia de la luz ambiental y la autofluorescencia en la señal. La elección de los accesorios para los experimentos de fotometría de fibra se puede encontrar en el siguiente artículo ¿Cómo elegir los accesorios de fotometría de fibra para la transmisión de señales más eficiente? - RWD Life Science (rwdstco.com)
Uno puede preguntarse, si inyecto dos colores de indicador fluorescente en la misma zona del cerebro, ¿cómo distingue el detector las dos señales diferentes? No se preocupe por esto, las dos señales pueden adquirirse de forma independiente controlando la luz de excitación y el tiempo de apertura específico del detector a través del software, o eligiendo añadir detectores adicionales.
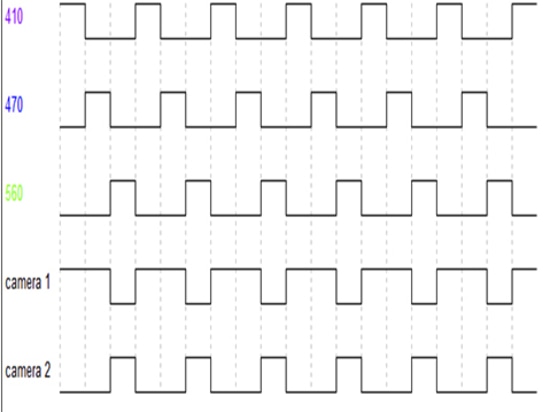
Como puede verse en la Figura 5, las fuentes de excitación LED de 410nm, LED de 470nm y LED de 560nm se alternan en la salida a una velocidad de cuadro específica (que puede ser establecida por el software). Los dos detectores, cámara1, sólo sincronizan la adquisición de la señal a la salida de los LEDs de 410 y 470nm (correspondiente a la recogida de la señal GFP), y la cámara2 sólo sincroniza la adquisición de la señal a la salida del LED de 560nm (correspondiente a la recogida de la señal RFP).
En el sistema de fotometría de fibra RWD, utilizamos un diseño de adquisición de doble detector más TDM (multiplexación por división de tiempo) (Sistema de fotometría de fibra multicanal RWD R820 - YouTube). Aunque más literatura ha confirmado que TDM ha sido capaz de evitar la interferencia mutua de la fluorescencia roja y verde. Sin embargo, el detector único utiliza un filtro de doble banda (que puede pasar tanto para el verde como para el rojo), y existe la posibilidad de que la diafonía se vea afectada muy poco. Porque existe una cierta posibilidad de que el LED de 470 nm excite la sonda fluorescente roja, permitiendo así que la fluorescencia roja se potencie y se produzca la diafonía.
Entonces, ¿cuál es la función del LED de 410 nm? ¿Por qué necesito el LED de 410nm para la excitación simultánea cuando se registran las señales de GCaMP? La intensidad de la fluorescencia del GCaMP mantiene un estado constante con el cambio de la concentración de Ca2+ intracelular cuando se excita con luz a una longitud de onda de 405 - 420 nm. Por lo tanto, se puede asumir hasta cierto punto que el cambio de señal correspondiente a la excitación a 410 nm refleja señales de ruido distintas al cambio de concentración de Ca2+, como la autofluorescencia, los cambios inducidos por el movimiento, el fotoblanqueo, etc. En el procesamiento de los datos, la señal de fondo puede ser dirigida a ser eliminada para obtener la verdadera señal.
La elección de un sistema adecuado le ayudará en su experimento. Si quiere saber más sobre el sistema de fotometría de fibra, póngase en contacto con nosotros