Ver traducción automática
Esta es una traducción automática. Para ver el texto original en inglés haga clic aquí
#Novedades de la industria
{{{sourceTextContent.title}}}
Embolectomía quirúrgica para el tromboembolismo pulmonar agudo
{{{sourceTextContent.subTitle}}}
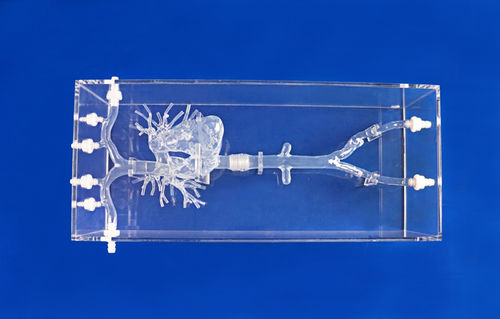
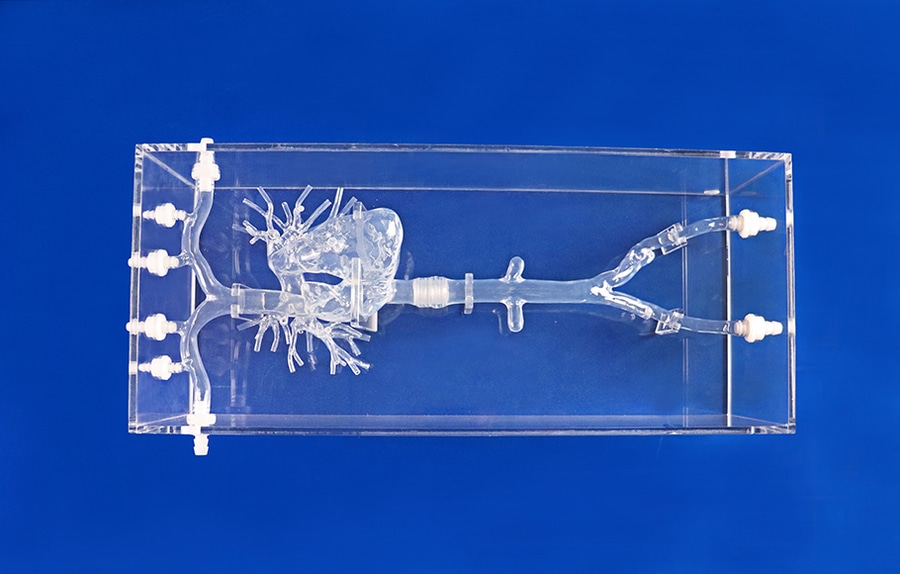
Arteria pulmonar I
{{{sourceTextContent.description}}}
El tromboembolismo pulmonar agudo (TEP) era una de las principales amenazas cardiopulmonares para los pacientes hospitalizados antes de la llegada del tratamiento anticoagulante con heparina. En 1906, Friedrich Trendelenburg informó en Leipzig de la ligadura de la vena cava inferior para evitar la progresión y embolización de trombos sépticos en la sepsis puerperal. En 1908 también intentó realizar una embolectomía pulmonar "sin circulación extracorpórea" a través de una toracotomía pequeña izquierda en pacientes con fractura del cuello femoral. Este procedimiento se basó en un estudio experimental; de hecho, el paciente murió de hemorragia durante la operación. Ningún paciente sobrevivió a este procedimiento hasta el primer informe exitoso de Martin Kirschner, antiguo aprendiz de Trendelenburg, en 1924. Se trataba de un procedimiento muy difícil con una mortalidad extremadamente alta, por lo que sólo se realizaba en pacientes en estado crítico, con resultados muy poco fiables e inciertos. La idea de la circulación extracorpórea inspiró a John Gibbon a desarrollar el bypass cardiopulmonar durante su tratamiento de un paciente con EP masiva en 1931. La idea inicial era aplicar la circulación extracorpórea para tratar la EP masiva, y comenzó a investigar sobre la circulación extracorpórea. En 1936 se introdujo la aplicación clínica de la heparina como profilaxis farmacológica y tratamiento de la tromboembolia venosa, 30 años después del descubrimiento de la heparina en 1916. Con el desarrollo del sistema de circulación extracorpórea y el uso de la heparina como anticoagulante, Denton Cooley y sus colegas realizaron una embolectomía pulmonar mediante bypass cardiopulmonar en 1961. También informaron del uso de la derivación cardiopulmonar "portátil" como puente para la embolectomía pulmonar quirúrgica. Sin embargo, tras la llegada de la terapia trombolítica en la década de 1970, la embolectomía pulmonar quirúrgica fue criticada como una modalidad terapéutica obsoleta porque los pacientes que necesitaban una embolectomía pulmonar estaban demasiado enfermos para ser trasladados a un centro cardiológico especializado. La terapia trombolítica es eficaz para resolver los coágulos en la arteria pulmonar; sin embargo, la mayoría de los estudios no han demostrado que la terapia trombolítica tenga una ventaja de supervivencia debido al riesgo de hemorragia crítica.
La circulación pulmonar tiene un enorme lecho capilar porque todo el retorno venoso sistémico va a parar a la circulación pulmonar. El lecho capilar pulmonar cubre casi la totalidad de los alvéolos, con una superficie total de 100-140 m2. Debido a que la vasculatura pulmonar tiene una amplia área endotelial, el pulmón tiene fuertes propiedades fibrinolíticas endógenas.
La mayoría de las tromboembolias pulmonares se generan en el lecho venoso de las extremidades inferiores como trombosis venosas profundas. El sistema venoso profundo está formado por múltiples tractos incrustados entre compartimentos musculares. Las paredes venosas son finas y muy elásticas, y funcionan como vasos de capacitancia y depósito de sangre. Las venas profundas de las extremidades tienen válvulas bilaterales para evitar la regurgitación de la sangre venosa hacia los pies. Hay muchos senos venosos en los músculos de la pantorrilla, especialmente en el músculo sóleo, que drenan en las venas tibial posterior y peronea. Los senos soleares son grandes, cortos, de paredes finas y sin válvulas. Están incrustados en el músculo sóleo y funcionan como un "corazón periférico" durante la deambulación para expulsar la sangre acumulada y resistir 80 mmHg de presión de la gravedad por debajo del corazón. Sin embargo, los senos soleares pueden convertirse en cunas de trombos venosos profundos si los pacientes están en reposo prolongado en cama o inmovilizados por una escayola combinada con otros factores trombogénicos como trombofilia o lesión de la íntima. Los trombos en los senos venosos soleales se extienden a las venas proximales, formando un trombo largo en forma de salchicha.
Desde el punto de vista anatómico, el tamaño de las venas profundas es un factor importante a la hora de considerar la gravedad de la EP. Los diámetros de las venas de la pantorrilla, la vena femoral y la vena ilíaca común son de 6-8, 8-10 y 10-12 mm, respectivamente. Por otro lado, la arteria pulmonar se hace más pequeña con la distancia al ventrículo derecho. Los diámetros del tronco pulmonar principal, las arterias pulmonares principales y las arterias lobares son de aproximadamente 25, 15 y 8 mm, respectivamente. Un trombo grande formado en la vena proximal de la pierna puede llegar a tener 8-10 mm de diámetro y 30-40 cm de longitud. Este gran trombo puede obstruir fácilmente las arterias pulmonares proximales, induciendo una EP masiva o submasiva.
Los efectos fisiopatológicos de la EP masiva o submasiva son la hipoxemia debida al desajuste ventilación-perfusión y la insuficiencia ventricular derecha debida a la reducción de los lechos vasculares arteriales pulmonares netos. La mortalidad de la embolia pulmonar masiva es muy elevada: 25% en pacientes con shock y 65% en pacientes con parada cardiorrespiratoria. La mayoría de las muertes por embolia pulmonar masiva se producen en los primeros días, especialmente varias horas después del inicio. Por lo tanto, la prevención de la tromboembolia venosa es crucial. También son importantes la detección y la intervención tempranas de la embolia pulmonar masiva y submasiva.
La estrategia de tratamiento de la embolia pulmonar masiva y submasiva consta de tres componentes: i) asistencia cardiopulmonar; ii) anticoagulación para prevenir la extensión y la recurrencia de la embolia pulmonar; y iii) reperfusión de la arteria pulmonar mediante trombólisis o eliminación mecánica de los émbolos. El primer paso sencillo en el soporte cardiopulmonar es la administración de oxígeno para el desajuste perfusión-ventilación y la administración de inotrópicos para el fallo ventricular derecho. Si falla el soporte inotrópico o el paciente sufre una parada cardiorrespiratoria, está indicado el soporte cardiopulmonar portátil (oxigenador de membrana extracorpórea venoarterial: V-A ECMO). El tratamiento anticoagulante también es importante para inhibir la extensión del trombo secundario en la arteria pulmonar. También es eficaz para inhibir la embolización del trombo venoso, que causaría una EP recurrente. La heparina debe iniciarse inmediatamente cuando se sospeche una EP, siempre que el paciente no tenga contraindicaciones para la anticoagulación, como una hemorragia activa del tracto gastrointestinal. La terapia de reperfusión es un enfoque racional para el tratamiento de la oclusión de las arterias pulmonares principales. La reperfusión farmacológica con activador tisular del plasminógeno (t-PA) es eficaz para mejorar la hemodinámica de la EP masiva o submasiva. El efecto trombolítico del t-PA alcanza el 80%; sin embargo, unos pocos ensayos aleatorizados han demostrado que el t-PA mejora el pronóstico de la embolia pulmonar masiva. Las complicaciones hemorrágicas, especialmente en pacientes de edad avanzada, son efectos adversos importantes del t-PA. La reperfusión mecánica consiste en la terapia con catéter y la embolectomía quirúrgica. La terapia con catéter fue desarrollada por Greenfield en 1969 utilizando un catéter en forma de copa; sin embargo, no se utiliza habitualmente debido a las incertidumbres sobre el procedimiento. Las intervenciones recientes con catéter incluyen varias modalidades con o sin el uso de trombólisis local. Aunque la trombólisis local en la arteria pulmonar es eficaz, resulta difícil en pacientes con contraindicaciones para la trombólisis, como los pacientes con ictus o tras una intervención quirúrgica mayor. La embolectomía o fragmentación con catéter es una alternativa a la embolectomía quirúrgica, y se han descrito excelentes resultados en la TEP masiva y submasiva. Dado que los pacientes con embolia pulmonar masiva presentan una hemodinámica inestable, a menudo es necesario utilizar asistencia cardiopulmonar o ECMO V-A para garantizar la seguridad de la intervención.