Ver traducción automática
Esta es una traducción automática. Para ver el texto original en inglés haga clic aquí
#Novedades de la industria
Las cosas entre el cáncer de tiroides y el gen TERT
Las cosas entre el cáncer de tiroides y el gen TERT
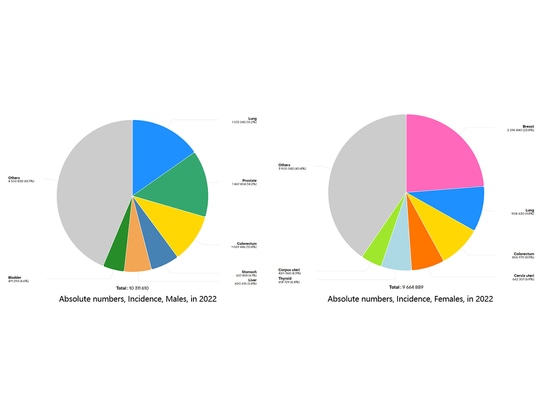
En los últimos años, la incidencia del cáncer de tiroides ha aumentado rápida y continuamente en muchos países y regiones de todo el mundo. Según las encuestas, hay más de 300 millones de personas en todo el mundo que padecen enfermedades tiroideas, entre las cuales las mujeres superan en ocho veces a los hombres, con una tasa de prevalencia de más del 10% entre las mujeres mayores de 40 años[1]
Figura 1 Los diez tipos de cáncer con más casos nuevos en el mundo en 2022
El cáncer de tiroides es el tumor endocrino maligno más frecuente. Según el origen y la diferenciación del tumor, puede dividirse en cáncer de tiroides diferenciado (CTD), cáncer de tiroides medular (CTM), cáncer de tiroides pobremente diferenciado (CTPD) y cáncer de tiroides indiferenciado (CTA). Entre ellos, el DTC se divide a su vez en cáncer papilar de tiroides (PTC) y cáncer folicular de tiroides (FTC)[2] Cuanto menor es el grado de diferenciación del tumor, mayor es su invasividad y peor es el pronóstico.
Los distintos subtipos de cáncer de tiroides tienen características genéticas moleculares diferentes. Por ejemplo, el PTC presenta comúnmente mutaciones del gen BRAF (ver "Lo que debe saber sobre el cáncer de tiroides y el gen BRAF"); el MTC presenta comúnmente mutaciones del gen RET (ver "Lo que debe saber sobre el cáncer de tiroides y el gen RET"); el FTC muestra comúnmente fusión PAX8-PPARγ o mutaciones RAS. En el PDTC y el ATC, las mutaciones genéticas comunes incluyen TP53, TERT, CDKN2A-RB1 y PTEN.[3-6] Cada gen mutado en estos subtipos conduce a la pérdida de control del ciclo celular, lo que da lugar a la carcinogénesis. Sin embargo, entre estas mutaciones, puede decirse que la mutación del gen TERT refuerza esta pérdida de control al eliminar las barreras intrínsecas del envejecimiento, otorgando así a las células una vida útil indefinida. Las investigaciones indican que la incidencia de mutaciones del gen TERT es del 10% al 15% en el DTC, del 40% al 45% en el PDTC y en el ATC, mientras que es rara en los nódulos benignos[3]. Por lo tanto, el gen TERT es un marcador tumoral importante para el diagnóstico y la evaluación de la agresividad en el cáncer de tiroides.
El gen TERT se localiza en el cromosoma 5p15.33, contiene 16 exones y 15 intrones, y codifica la transcriptasa inversa de la telomerasa, que desempeña un papel crucial en el mantenimiento de la estabilidad de los telómeros, la integridad del genoma, la actividad celular a largo plazo y la capacidad proliferativa ilimitada de las células tumorales[7]. Forma la telomerasa junto con el componente de ARN de la telomerasa (TERC), crucial para mantener la longitud de los telómeros y determinar la actividad de la telomerasa. En las células normales, la actividad de la telomerasa suele estar muy regulada, con niveles bajos en la mayoría de los tejidos, y sólo está presente y muy regulada en unas pocas células, como las células germinales y las células madre hematopoyéticas. Sin embargo, en las células tumorales, más del 90% presentan sobreexpresión de telomerasa, lo que permite el mantenimiento o el alargamiento de los telómeros, dando lugar a la proliferación maligna y a la inmortalidad[8]. La activación de TERT se debe principalmente a mutaciones que se producen en la región promotora, siendo las más comunes la mutación puntual C228T aguas arriba del sitio de inicio de la transcripción de TERT y la mutación puntual C250T. En el cáncer de tiroides, la mutación C228T es más común que la C250T, y ambas se excluyen mutuamente[9]. Las mutaciones del promotor de TERT pueden aumentar los niveles de transcripción de TERT, pero la expresión está regulada por factores de transcripción ETS, siendo los más estrechamente relacionados la proteína A de unión a GA (GABPA) y la proteína B de unión a GA (GABPB). Los estudios han demostrado que las mutaciones del promotor de TERT generan nuevos sitios de unión del factor de transcripción ETS, donde el complejo GABPA-GABPB se une típicamente a los sitios de unión del factor de transcripción ETS como un heterotetrámero, promoviendo así la transcripción de TERT y la activación de la telomerasa, y facilitando el inicio y la progresión del tumor[10] Los factores de transcripción ETS, especialmente GABPA o GABPB1, se han propuesto como nuevas dianas para la terapia del cáncer.
Figura 3 El mecanismo carcinogénico del gen TERT
01. Mutaciones del promotor de TERT y pronóstico en el cáncer de tiroides
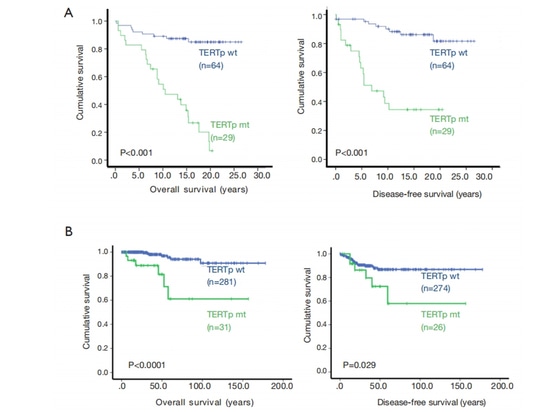
Un estudio comparó la supervivencia global y la supervivencia libre de enfermedad de 93 pacientes con carcinoma papilar de tiroides (CPT) que tenían el promotor TERT de tipo salvaje (wt) o de tipo mutante (mt). Los resultados mostraron una supervivencia global y una supervivencia libre de enfermedad significativamente menores en los pacientes con TERT mt. Este hallazgo fue validado por un estudio de la cohorte TCGA. Numerosos estudios clínicos han demostrado una fuerte asociación entre las mutaciones del promotor TERT y la enfermedad avanzada o progresiva, impactando significativamente en el pronóstico o la tasa de mortalidad de los pacientes con cáncer de tiroides [11].
Figura 4 Mutación del promotor del gen TERT y pronóstico
02. Efecto sinérgico de TERT y la mutación BRAF V600E
Liu et al. descubrieron que el factor de transcripción FOS puede ser fosforilado y activado por la vía de señalización MAPK mediada por BRAF V600E, y se une a GABPB para aumentar su expresión. Esto conduce a un aumento en la formación del complejo GABPA-GABPB, que se une al promotor mutado de TERT, activando TERT. Esto también explica por qué las mutaciones en el promotor de TERT coexisten frecuentemente con las mutaciones BRAF V600E en el PTC, y la presencia de estas dos mutaciones se asocia con un aumento de la invasividad, de las metástasis en ganglios linfáticos y a distancia, de la recurrencia tumoral y de las tasas de mortalidad [12].
Figura 5 Cooperación oncogénica entre el promotor TERT y la mutación BRAF V600E
03. Mutación del promotor de TERT y tratamiento
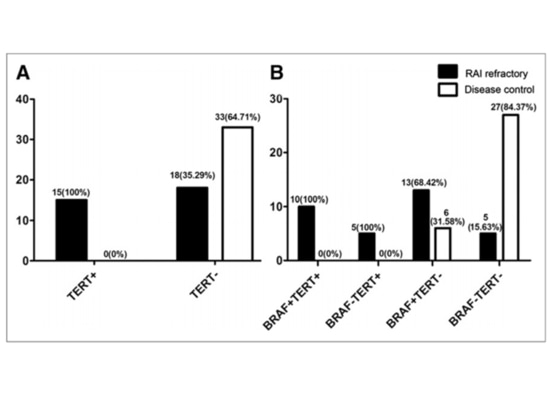
El 131I radioactivo es una terapia adyuvante importante para el cáncer de tiroides, que puede reducir la recurrencia y prolongar la supervivencia. Sin embargo, la resistencia al yodo radiactivo también es un fenómeno que puede encontrarse clínicamente, lo que indica una respuesta deficiente de los pacientes a la terapia con isótopos radiactivos. Numerosos estudios han hallado una correlación significativa entre la presencia de mutaciones en el promotor de TERT y una menor captación de 131I o resistencia al yodo. Por lo tanto, las mutaciones del promotor de TERT pueden servir como factores predictivos tempranos de la resistencia al yodo radiactivo. Cuando las mutaciones del promotor de TERT se combinan con mutaciones dobles de BRAF V600E, sugieren insensibilidad al yodo radiactivo y poca eficacia de la terapia isotópica, mientras que los estudios han demostrado que el tratamiento combinado con inhibidores de BRAF V600E y MEK tiene mejor eficacia, y puede realizarse una disección preventiva de los ganglios linfáticos del cuello para mejorar las tasas de curación[14-15]. Debido a que las mutaciones del promotor de TERT conducen a la activación de la telomerasa, que a su vez conduce a la aparición y el desarrollo del cáncer de tiroides, la inhibición de la actividad de la telomerasa también es una opción de tratamiento potencial. Imetelstat (GRN163L), un inhibidor de la telomerasa, ha demostrado inhibir eficazmente la actividad de la telomerasa en diversas células malignas y es el único inhibidor de la telomerasa incluido en ensayos clínicos[16]. GRN163L ha demostrado ser muy eficaz en el tratamiento de tumores mieloproliferativos, y su aplicación en el tratamiento del cáncer de tiroides con GRN163L también es probable que sea un método de tratamiento eficaz, incluso explorando el tratamiento combinado con inhibidores de BRAF es una opción de tratamiento prometedor[17].
Figura 6 Relación entre las mutaciones TERT/BRAF y la respuesta a la terapia con yodo radiactivo
TERT desempeña un papel crucial en la progresión tumoral y el empeoramiento del pronóstico. Las posibles aplicaciones clínicas de la expresión de TERT y la activación o inhibición de la actividad de la telomerasa siguen estando a la vanguardia de muchas estrategias de tratamiento del cáncer. Las mutaciones del promotor de TERT sirven como marcadores específicos para el diagnóstico y el pronóstico del cáncer de tiroides. Cuando se combinan con la mutación BRAF V600E u otros marcadores genéticos (como las mutaciones RAS), pueden ayudar a evitar diagnósticos erróneos del cáncer de tiroides, evaluar mejor el pronóstico de los pacientes y sugerir opciones de tratamiento.
Referencias:
[1] IARC Global Cancer Burden Data 2022.
[2] Thyroid Cancer Diagnosis and Treatment Guidelines (edición de 2022).
[3] Consenso de expertos sobre pruebas genéticas y aplicaciones clínicas del cáncer de tiroides en Guangdong (edición de 2020).
[4] Consenso de Expertos sobre Pruebas Genéticas y Aplicaciones Clínicas del Cáncer de Tiroides RET (edición 2021).
[5] Consenso de Expertos sobre Diagnóstico y Tratamiento del Carcinoma Indiferenciado de Tiroides (edición 2023).
[6] J Clin Invest 2016,126:1052-66.
[7] Science 2013,339,957-959.
[8] Life Sci,2020,257:118115.
[9] Endocr Relat Cancer. (2016) 23:R143-55.
[10] Células sanguíneas Mol Dis 2004;32:143-54.
[11] Anales de medicina traslacional, 2020, 8(19).
[12] Nat Commun 2018;9:579.
[13] J Nucl Med 2017,58:258-65.
[14] Endocrinol Metab Clin North Am, 2019,48(1):109-124.
[15] Proc Natl Acad Sci U S A 2020,117:15846-51.
[16] Curr Top Med Chem 2020,20:410-32.
[17] Biochem Biophys Res Commun 2020,527:425-31.
Descargo de responsabilidad: Este artículo es sólo para compartir. Si hay algún problema de derechos de autor, póngase en contacto con nosotros lo antes posible, y lo corregiremos con prontitud. Gracias