Ver traducción automática
Esta es una traducción automática. Para ver el texto original en inglés haga clic aquí
#Novedades de la industria
El sistema de monitorización del metabolismo animal Tow-Int Tech
Apoya la investigación sobre la anorexia y la obesidad
Introducción
Recientemente, investigadores nacionales, entre ellos Zijun Chen, Yixiao Luo, Yingjie Zhu y otros, estudiaron el mecanismo de acción de la liraglutida en ratones. Descubrieron que las neuronas positivas para el receptor GLP-1 (GLP-1R) del septum lateral (LS) desempeñan un papel crucial en los efectos anoréxicos y de pérdida de peso de la liraglutida. Sus hallazgos se publicaron en The Journal of Clinical Investigation, que tuvo un factor de impacto de 15,9 en 2023 y un factor de impacto a cinco años de 14,6.
1. Antecedentes de la investigación
La obesidad es una amenaza sanitaria mundial y la liraglutida, un análogo del péptido-1 similar al glucagón (GLP-1), se utiliza para tratarla. Sin embargo, los lugares neuronales específicos de su acción siguen sin estar claros. Las células del sistema nervioso central que expresan GLP-1R son fundamentales para los efectos anoréxicos y adelgazantes de la liraglutida. El hipotálamo ha sido uno de los principales focos de investigación, pero la supresión genética del GLP-1R en esta región no afecta a la acción de la liraglutida. Las regiones del rombencéfalo, como el área caudal, también han despertado interés, aunque existen hallazgos contradictorios. El septum lateral (LS) también expresa GLP-1R y está implicado en la regulación energética, pero la función fisiológica de sus neuronas y su papel en los efectos de la liraglutida siguen sin estar definidos.
2. Objetivo de la investigación
El estudio pretende desvelar el papel de los GLP-1R en el septo lateral en los efectos fisiológicos y farmacológicos de la liraglutida, incluyendo la regulación de la homeostasis energética y su implicación en los efectos anoréxicos y de pérdida de peso inducidos por la liraglutida.
3. Métodos experimentales
Modelos animales: Se utilizaron varios ratones transgénicos, incluyendo ratones GLP-1R-ires-Cre, ratones reporteros Ai14, ratones Rosa26-LSL-Cas9 y ratones C57BL/6J de tipo salvaje.
Técnicas:
Inmunohistoquímica: Para determinar la distribución de los GLP-1R en el cerebro del ratón.
Inyección de vectores virales: Incluido el uso de la tecnología CRISPR/Cas9 para anular selectivamente la expresión del GLP-1R en neuronas específicas o sobreexpresar el GLP-1R.
Quimiogenética y optogenética: Para activar o inhibir neuronas GLP-1R positivas en el septum lateral.
Fotometría de fibra: Para registrar la actividad neuronal.
Electrofisiología: Para estudiar la transmisión sináptica en las neuronas.
Experimentos conductuales: Incluidas mediciones de la ingesta de alimentos, evaluaciones del peso corporal, pruebas orales de tolerancia a la glucosa y pruebas condicionadas de aversión al sabor.
4. Resultados experimentales
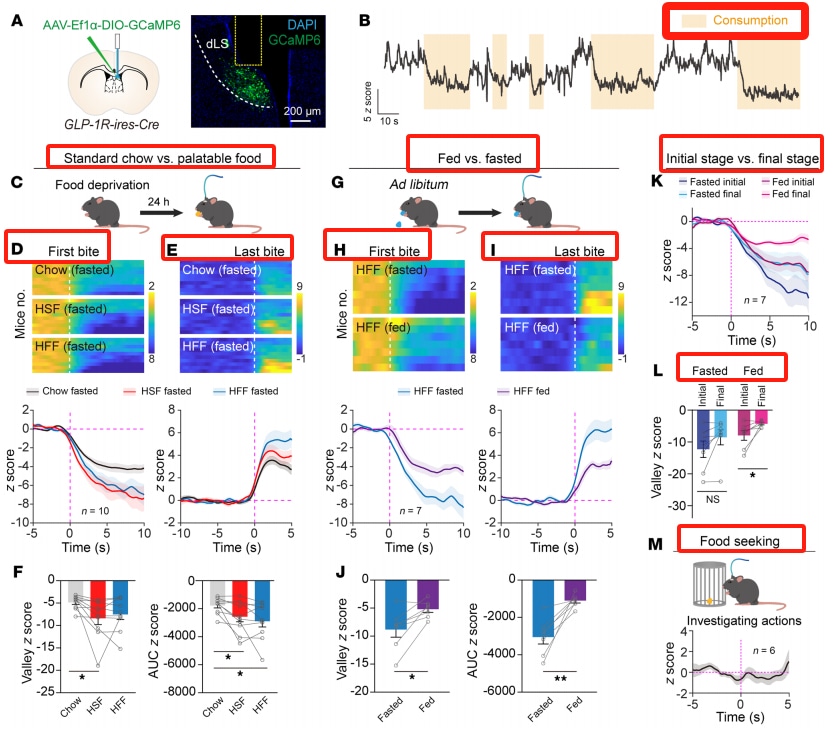
La liraglutida activa las neuronas GLP-1R en el septo lateral. La inmunohistoquímica reveló que las neuronas GLP-1R positivas están densamente distribuidas en la parte dorsal del septo lateral (LS). Tras la inyección intraperitoneal de liraglutida, la expresión de c-Fos se elevó en el LS, el núcleo paraventricular (PVN) y el área caudal (AP). Mediante el cruce de ratones GLP-1R-ires-Cre con ratones reporteros Ai14, se marcaron las neuronas GLP-1R positivas en el LS, y se descubrió que la inyección intraperitoneal de liraglutida aumentaba significativamente la expresión de c-Fos en estas neuronas. La infusión local de liraglutida en el LS también tuvo el mismo efecto, aumentando la amplitud de las corrientes postsinápticas excitatorias.
La eliminación del GLP-1R en el LS debilita los efectos de la liraglutida
Utilizando la tecnología CRISPR/Cas9, se eliminó específicamente la expresión del GLP-1R en las neuronas GLP-1R positivas del septum lateral dorsal (SLD). La eliminación no afectó a la ingesta de alimentos ni al peso corporal de los ratones, pero debilitó los efectos de la liraglutida sobre la ingesta de alimentos y la pérdida de peso. La supresión del GLP-1R en el núcleo paraventricular (PVN) y el núcleo arqueado (Arc) no alteró los efectos anoréxicos de la liraglutida.
La sobreexpresión del GLP-1R en el DLS reduce el consumo de alimentos en ratones saciantes
La sobreexpresión del GLP-1R en el septum lateral dorsal (dLS) redujo significativamente el consumo de alimentos en ratones saciantes, pero no tuvo ningún efecto sobre la ingesta de alimentos en ratones en ayunas. Además, no alteró el peso corporal crónico ni los parámetros metabólicos.
El silenciamiento de las neuronas GLP-1R del LS aumenta el consumo de alimentos y favorece la obesidad
El silenciamiento de las neuronas LS GLP-1R (mediante la inyección de AAV que expresa toxina tetánica) aumenta la ingesta de alimentos ricos en grasas y el peso corporal, así como el consumo de alimentos apetitosos. Sin embargo, no afecta a la tolerancia a la glucosa ni al consumo de agua, pero aumenta el gasto energético y la relación de intercambio respiratorio. El silenciamiento de estas neuronas debilita el efecto de la liraglutida sobre la ingesta de alimentos y la pérdida de peso, pero no afecta a las náuseas inducidas por la liraglutida.
La actividad de las neuronas GLP-1R del LS disminuye rápidamente durante la alimentación
Los registros de fotometría de fibra mostraron que, cuando los ratones privados de alimento empezaban a comer, la señal de Ca²⁺ de las neuronas GLP-1R del LS disminuía significativamente, volviendo a los niveles basales tras cesar la ingesta. La disminución fue más pronunciada cuando la comida era más apetecible. Cuando se presentaba comida rica en grasas a ratones saciados, la respuesta inhibitoria era menor, y la inhibición durante la alimentación disminuía gradualmente. El comportamiento de búsqueda de comida no afectó a la actividad neuronal.
La activación de las neuronas LS GLP-1R reduce el consumo de alimentos
La activación de las neuronas LS GLP-1R mediante quimiogenética u optogenética puede reducir el consumo de alimentos y suprimir el apetito sin afectar a la homeostasis de la glucosa. Las neuronas LS GLP-1R se proyectan a varias regiones cerebrales implicadas en la regulación de la alimentación.
5. Conclusiones de la investigación
La liraglutida activa las neuronas GLP-1R positivas en el septo lateral, y los GLP-1R de esta región desempeñan un papel importante en los efectos anoréxicos y reductores de peso de la liraglutida. Las neuronas GLP-1R del septum lateral son clave tanto en la saciedad fisiológica como en los efectos inducidos por la liraglutida, lo que aporta nuevos conocimientos sobre el mecanismo de acción de la liraglutida y posibles puntos de intervención específicos para el tratamiento de la obesidad.
Resultados de la investigación:
Profundización en el conocimiento de los mecanismos de la obesidad: Este estudio aclara la importancia de las neuronas GLP-1R positivas del septum lateral en la regulación de la homeostasis energética, contribuyendo a comprender los mecanismos neurobiológicos de la obesidad humana. La obesidad está estrechamente relacionada con desequilibrios en la ingesta y el gasto de energía, y las vías neuronales reveladas en este estudio desempeñan un papel crítico, ofreciendo una nueva perspectiva sobre la fisiopatología de la obesidad.
Explicación de los mecanismos de los efectos secundarios de los fármacos: El estudio descubrió que las neuronas LS GLP-1R no participan en las náuseas inducidas por la liraglutida, lo que sugiere que otras regiones del cerebro intervienen en la respuesta a las náuseas. Esto ayuda a explicar por qué algunos pacientes experimentan efectos secundarios como las náuseas cuando utilizan agonistas del GLP-1R (por ejemplo, liraglutida) para tratar la obesidad o la diabetes, proporcionando una base teórica para futuras investigaciones que aborden estos efectos secundarios.
Identificación de posibles dianas farmacológicas: La investigación pone de relieve el papel crítico de los GLP-1R en el tabique lateral en los efectos de la liraglutida, lo que sugiere que esta región o sus neuronas relacionadas pueden ser objetivos potenciales para el tratamiento de la obesidad y las enfermedades metabólicas relacionadas. El desarrollo de fármacos dirigidos a esta vía podría mejorar la eficacia y la seguridad de los tratamientos, reduciendo al mismo tiempo los efectos secundarios.
Optimización de las estrategias de tratamiento farmacológico: Los hallazgos podrían ayudar a desarrollar métodos de tratamiento farmacológico más precisos, como la modulación de la actividad de las neuronas GLP-1R positivas en el tabique lateral para potenciar los efectos anoréxicos y de pérdida de peso de la liraglutida, evitando o reduciendo al mismo tiempo efectos adversos como las náuseas. Esto abre posibilidades para la medicina personalizada.
Promover enfoques terapéuticos combinados: Dado que los GLP-1R de distintas regiones cerebrales pueden actuar conjuntamente para mediar en los efectos de la liraglutida, en el futuro el desarrollo de fármacos podría considerar el diseño de estrategias de tratamiento combinadas dirigidas a múltiples vías o regiones cerebrales relevantes para mejorar la eficacia de los tratamientos de la obesidad y las enfermedades relacionadas.
En este estudio se utilizó el sistema de monitorización del metabolismo animal de Tow-Int Tech, que mide parámetros como el consumo de energía, la ingesta de oxígeno (VO₂), la producción de dióxido de carbono (VCO₂), la relación de intercambio respiratorio, la ingesta de agua y alimentos y otros parámetros metabólicos. Este sistema permite la monitorización a largo plazo en ratones en condiciones naturales de actividad, proporcionando datos de apoyo para estudiar los efectos de los fármacos o la modulación neuronal sobre el metabolismo energético.
Medición del gasto energético (EE):
El gasto energético se mide monitorizando el consumo de oxígeno (VO₂) y la producción de dióxido de carbono (VCO₂) de los ratones durante un periodo de tiempo en el sistema de metabolismo energético, y calculando después el gasto energético mediante fórmulas específicas. Esto ayuda a comprender los cambios en el consumo de energía de los ratones en diferentes condiciones experimentales (por ejemplo, la activación o inhibición de las neuronas LS GLP-1R) y evaluar el impacto de estas manipulaciones en el nivel general del metabolismo energético de los ratones.
Monitorización del consumo de oxígeno (VO₂) y de la producción de dióxido de carbono (VCO₂):
Las mediciones continuas y en tiempo real de VO₂ y VCO₂ en ratones dentro del sistema de metabolismo energético proporcionan datos de intercambio de gases bajo diferentes estados de actividad (como periodos activos y de reposo). El estudio descubrió que en determinadas condiciones experimentales (por ejemplo, tras silenciar las neuronas LS GLP-1R), los niveles de VO₂ y VCO₂ estaban alterados. Esto proporciona datos fundamentales para analizar la relación entre la actividad neuronal y el metabolismo energético.
Cálculo de la relación de intercambio respiratorio (RER):
El RER es la relación entre la producción de VCO₂ y el consumo de VO₂ y refleja la utilización metabólica de carbohidratos y grasas en el ratón. El estudio calcula el RER utilizando datos del sistema de metabolismo energético y descubrió que, mientras que el VO₂ y el VCO₂ cambiaban en algunas condiciones (por ejemplo, tras silenciar las neuronas LS GLP-1R), el RER no cambiaba. Esto sugiere que la utilización del sustrato metabólico de los ratones no sufrió cambios sustanciales en estas condiciones, profundizando aún más nuestra comprensión de la regulación neuronal del metabolismo energético.
Medición simultánea de la ingesta de alimentos y agua:
El sistema de metabolismo energético puede medir los parámetros del metabolismo energético mientras registra simultáneamente la ingesta de comida y agua de los ratones. Esto permite un análisis exhaustivo del equilibrio entre la ingesta y el gasto de energía, así como de los efectos de diferentes tratamientos experimentales sobre este equilibrio. Por ejemplo, al estudiar la relación entre las manipulaciones de las neuronas LS GLP-1R y los cambios en la ingesta de alimentos, la combinación de los datos sobre el consumo de energía medidos por la jaula metabólica proporciona una comprensión más completa del papel de estas neuronas en la regulación de la homeostasis energética.
El sistema de monitorización del metabolismo animal de Tow-Int Tech ha proporcionado datos completos y continuos del metabolismo energético de ratones, lo que resulta crucial para revelar los mecanismos por los que las neuronas GLP-1R de LS regulan el equilibrio energético. Proporciona un sólido apoyo para los análisis y conclusiones posteriores.
Póngase en contacto con nosotros
Nos comprometemos a hacer que su investigación sea más fácil, precisa y eficiente, y a ayudarle a generar confianza en sus datos Hemos prestado servicios a un gran número de clientes, lo que nos ha proporcionado una gran experiencia a la hora de ofrecer soluciones personalizadas y profesionales en función de sus necesidades.