Ver traducción automática
Esta es una traducción automática. Para ver el texto original en inglés haga clic aquí
#Novedades de la industria
Aplicaciones del pletismógrafo de cuerpo entero en la sepsis
La sepsis puede provocar SDRA, y la PSB, como importante herramienta de prueba de la función pulmonar, se utiliza a menudo en experimentos con animales.
1. Antecedentes Introducción de la sepsis
La sepsis es una reacción sistémica grave desencadenada por una infección bacteriana, pero también puede estar causada por infecciones por virus, hongos u otros patógenos. Puede provocar disfunción orgánica, perfusión tisular insuficiente y metabolismo celular anormal. Cuando la respuesta del organismo a una infección se descontrola y empieza a dañar sus propios tejidos y órganos, se produce la sepsis. Puede evolucionar rápidamente a sepsis grave con disfunción orgánica aguda e incluso convertirse en shock séptico, que se caracteriza por una caída significativa de la presión arterial y la incapacidad de mantener un flujo sanguíneo suficiente a los órganos vitales incluso con reanimación con líquidos. Los focos de infección más comunes son las infecciones pulmonares (como la neumonía), las infecciones urinarias, las infecciones intraabdominales (como la perforación del apéndice), las infecciones cutáneas, etc. Cualquier tipo de infección puede desencadenar una sepsis en condiciones adecuadas.
El sistema de pletismografía de cuerpo entero (WBP) puede utilizarse para monitorizar la función respiratoria de animales de experimentación despiertos, en movimiento libre, sin ataduras y no anestesiados, así como para detectar la hiperreactividad de las vías respiratorias. Evita los efectos de la traqueotomía traumática y la anestesia. Los animales pueden sobrevivir después del experimento, lo que lo convierte en un método experimental ideal para estudios de seguimiento a largo plazo. Puede realizar pruebas con varios animales simultáneamente, lo que lo convierte en la mejor opción para experimentos de cribado.
El sistema WBP puede utilizarse en la investigación de la sepsis y también es especialmente adecuado para estudios de alto rendimiento, como el cribado primario de fármacos, el análisis farmacológico y de eficacia y el análisis toxicológico, así como para estudios de seguimiento a largo plazo. Los parámetros respiratorios medidos por este sistema, como la frecuencia respiratoria, el volumen corriente, el volumen minuto de ventilación, el flujo espiratorio máximo, el flujo inspiratorio máximo, el tiempo espiratorio, el tiempo inspiratorio y la relación del tiempo de flujo espiratorio máximo (Rpef), tienen una alta correlación con los resultados de las pruebas clásicas de función pulmonar.
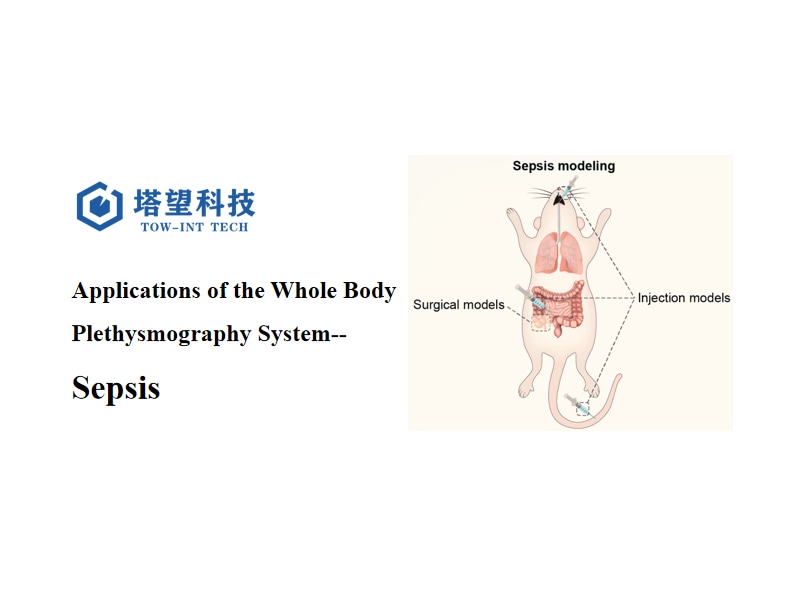
2. Modelos de sepsis en ratones utilizados habitualmente
2.1 Modelo de ligadura y perforación cecal (CLP):
Es uno de los modelos animales de sepsis más utilizados. Induce una infección intraperitoneal mediante la ligadura y perforación quirúrgica parcial del ciego, simulando así la sepsis causada por una infección endógena intraabdominal en humanos. Se considera que el modelo CLP se aproxima a la situación clínica de la sepsis porque implica una mezcla compleja de patógenos y el desarrollo progresivo de disfunción orgánica múltiple.
2.2 Modelo de inyección de lipopolisacárido (LPS):
El LPS es el principal componente de la membrana externa de la pared celular de las bacterias Gram negativas. La inyección de LPS por vía intravenosa o intraperitoneal puede inducir una respuesta inflamatoria sistémica similar a la de la sepsis humana. Aunque este modelo es fácil de manejar, provoca principalmente una respuesta inflamatoria aguda y carece de las características multietapa típicas de la sepsis.
2.3 Modelo de inoculación bacteriana:
Inyectar tipos específicos de bacterias vivas (como Escherichia coli, Staphylococcus aureus, etc.) directamente en el cuerpo del animal para inducir una infección local o sistémica, que luego se convierte en sepsis. Este método permite ajustar la gravedad de la enfermedad seleccionando diferentes tipos de bacterias y dosis según sea necesario.
2.4 Modelo de instilación intratraqueal:
La instilación intratraqueal de bacterias o sus productos (como LPS) se utiliza para simular la sepsis causada por una infección pulmonar. Este método es especialmente adecuado para estudiar la sepsis relacionada con la neumonía.
3. El modelo de síndrome de dificultad respiratoria aguda (SDRA) asociado a la sepsis en ratones se induce mediante el método de ligadura y perforación cecal (CLP). Los pasos específicos son los siguientes
Preparación de los animales de experimentación: Seleccionar ratones C57BL/6 machos sanos de 6-8 semanas de edad y 22 ± 2 g de peso.
Tratamiento anestésico: Anestesiar los ratones con isoflurano.
Operación quirúrgica: Después de que la anestesia haga efecto, exponer el ciego del ratón. Ligar el ciego aproximadamente a 1 cm del extremo del ciego. A continuación, puncione el ciego con una aguja de calibre 16 en una posición a 0,5 cm del extremo del ciego. Después de completar las operaciones anteriores, suturar la incisión capa por capa.
Reanimación postoperatoria: Después de la operación, ayudar a los ratones a recuperarse mediante la inyección subcutánea de 0,5 ml de solución salina normal estéril precalentada en la parte posterior de los ratones.
Creación del grupo de control: Para los ratones del grupo de control, el ciego no se liga ni se perfora, y el resto de los procedimientos quirúrgicos son los mismos que los del grupo modelo.
Administración del fármaco: Inmediatamente después del establecimiento del modelo, a los ratones del grupo GL + CLP se les inyecta por vía intraperitoneal ácido glicirrícico (GL, 15mg/kg). GL se disuelve en 200 μl de disolvente (2% DMSO + 40% peg300 + 5% Tween80 + 53% ddh2O).
Detección de la función pulmonar: Realizar la detección de la función pulmonar en el grupo modelo y en los ratones del grupo en blanco 16-20 horas después de la operación.
Recogida de muestras: Obtener las muestras necesarias 24 horas después de la operación.
4. Métodos de evaluación de la sepsis
4.1 Observar la tasa de supervivencia a los 7 días:
Evaluar observando y registrando el estado de supervivencia de los ratones a los 7 días. La tasa de supervivencia de los ratones del grupo CLP es baja. el 80% de ellos sobrevive a las 24 horas, y sólo el 10% sobrevive a los 7 días, y no hay más muertes después de 72 horas. Mientras que la tasa de supervivencia a las 24 horas del grupo GL+CLP es del 85%, y la tasa de supervivencia a los 7 días es del 40%, y no hay muertes después de 42 horas. La tasa de supervivencia es significativamente inferior al nivel normal, lo que concuerda con las características de la sepsis grave y la elevada tasa de letalidad, y refleja indirectamente el éxito del establecimiento del modelo.
4.2 Examen patológico del tejido pulmonar:
Se realiza una tinción de hematoxilina-eosina (HE) en el tejido pulmonar del ratón, se observan los cambios patológicos del tejido pulmonar y se calcula la puntuación de la lesión pulmonar. En comparación con el grupo de control, el tejido pulmonar de los ratones del grupo CLP está gravemente dañado. La estructura alveolar está destruida, el intersticio pulmonar está significativamente engrosado, acompañado de hemorragias y un gran número de infiltraciones de células inflamatorias, y la puntuación de lesión pulmonar aumenta significativamente. Estas características patológicas concuerdan con el SDRA inducido por sepsis, lo que indica el éxito del modelo.
4.3 Detección de la relación húmedo/seco (W/D) del tejido pulmonar y la concentración de proteínas en el líquido de lavado broncoalveolar (BALF):
La relación W/D del pulmón y la concentración de proteínas en el BALF de los ratones del grupo CLP aumentan significativamente. Estos dos indicadores son indicadores importantes que reflejan el daño de la barrera alveolo-capilar y el aumento de la permeabilidad del tejido pulmonar durante el SDRA. Los cambios en estos indicadores indican que los ratones modelo presentan cambios patológicos similares al SDRA, lo que respalda el éxito del establecimiento del modelo de sepsis.
4.4 Detección de la formación de trampas extracelulares de neutrófilos (NET) en el tejido pulmonar:
Detectar el contenido de Cit-H3 (un marcador de NETs) en el tejido pulmonar mediante tinción de inmunofluorescencia. El contenido de Cit-H3 en el tejido pulmonar de los ratones del grupo CLP es superior al del grupo de control, lo que significa que aumenta la formación de NETs. Dado que los NETs están relacionados con la progresión de la sepsis, el aumento de su cantidad indica que se ha producido una respuesta inmunitaria relacionada con la sepsis en los ratones, lo que constituye una de las pruebas del éxito del establecimiento del modelo.
4.5 Detección de la expresión de proteínas y genes en las vías de señalización relacionadas:
Utilizar western blot y PCR cuantitativa en tiempo real para detectar los niveles de expresión de proteínas y genes de HMGB1, TLR9, MyD88 e IL6 en el tejido pulmonar respectivamente. La expresión de estas moléculas en el grupo CLP aumenta significativamente. Están implicadas en la regulación de la respuesta inflamatoria y la formación de NETs en la sepsis, y los cambios en su expresión son consistentes con el mecanismo patológico de la sepsis, confirmando además el éxito del establecimiento del modelo.
4.6 Evaluación de la función pulmonar:
La función pulmonar de los ratones puede detectarse utilizando el sistema de pletismografía de cuerpo entero desarrollado por TaWang Technology. Muchos indicadores de la función pulmonar de los ratones del grupo CLP cambian significativamente en comparación con los del grupo de control. Por ejemplo, F, Vt y MV, que reflejan la ventilación alveolar, disminuyen, lo que indica una reducción de la ventilación alveolar; PIF, PEF y Rpef, que reflejan la fuerza de los músculos respiratorios y la pequeña obstrucción de las vías respiratorias, disminuyen, lo que indica la aparición de fatiga respiratoria y limitación del flujo aéreo; Ti y Te se prolongan, lo que indica la presencia de obstrucción respiratoria o edema pulmonar; EF50 aumenta y Tr se prolonga, lo que indica un aumento de la resistencia de las vías respiratorias. Estos cambios en la función pulmonar concuerdan con las características del SDRA inducido por sepsis, lo que indica el éxito del modelo.
5. Tow-Int Tech - Sistema de pletismografía de cuerpo entero, WBP
El sistema de pletismografía de cuerpo entero (WBP) desarrollado por Tow-Int Tech puede medir los parámetros respiratorios de animales despiertos y en movimiento libre, como la frecuencia respiratoria, el volumen corriente y las pruebas de hiperreactividad de las vías respiratorias (AHR). Durante la prueba, los animales pueden estar en estado de vigilia y libertad, evitando los efectos de la traqueotomía traumática y la anestesia, lo que hace más cómodo el proceso experimental. Se utiliza para el estudio de la capacidad de respuesta de los animales en modelos del sistema respiratorio a fármacos y otras sustancias, así como para los estudios farmacológicos y toxicológicos de fármacos respiratorios. Es especialmente adecuado para pruebas rápidas de cribado primario de un gran número de animales, estudios de seguimiento a largo plazo y cribado repetitivo.
Especies animales aplicables: Ratones, ratones jóvenes, ratas, cobayas, conejos, perros, gatos, cerdos en miniatura, monos y otros animales.
Está equipado con un dispositivo de alimentación y riego para facilitar los experimentos a muy largo plazo.
Canales de medición: 1-64 canales.
Función de control automático del flujo de polarización.
Puede configurarse con un sistema de administración de fármacos por nebulización oscilante de alta frecuencia.
Tiene un diseño especial de estructura de reducción de ruido, que puede reducir eficazmente la interferencia causada por los cambios ambientales.
Puede realizar la reducción de ruido del medidor de flujo de polarización para mejorar la relación señal-ruido de la señal y reducir el ruido del sistema.
Admite la conexión externa de nitrógeno u otros gases para completar los experimentos de hipoxia.
Dispone de software de análisis, y los datos pueden guardarse en formato excel o txt.
El software puede conmutar automáticamente hasta cuatro canales de gases diferentes y puede manejarse a través de un controlador externo.
Referencias
[1. Gu J, Ran X, Deng J, et al. Glycyrrhizin alleviates sepsis-induced acute respiratory distress syndrome via suppressing of HMGB1/TLR9 pathways and neutrophils extracellular traps formation[J]. Internacional de inmunofarmacología, 2022, 108: 108730.
[2. Ruan D, Yang J, Luo Q, et al. Los efectos protectores de Goitrin en shock séptico inducido por LPS en ratones C57BL/6J a través de Caspase-11 no canónica Inflammasome inhibición [J]. Moléculas, 2023, 28(7): 2883.
[3]Silva-Santos Y, Pagni R L, Gamon T H M, et al. Lisinopril increases lung ACE2 levels and SARS-CoV-2 viral load and decreases inflammation but not disease severity in experimental COVID-19[J]. Frontiers in Pharmacology, 2024, 15: 1414406.
[4]Sordillo P P, Allaire A, Bouchard A, et al. The complex lipid, SPPCT-800, reduces lung damage, improves pulmonary function and decreases pro-inflammatory cytokines in the murine LPS-induced acute respiratory distress syndrome (ARDS) model[J]. Biología Farmacéutica, 2022, 60(1): 1255-1263.
[5. Li H, Zou Q, Wang X. Bisdemethoxycurcumin alleviates LPS-induced acute lung injury via activating AMPKα pathway [J]. BMC Farmacología y Toxicología, 2023, 24(1): 63.
[6]Rivera J, Nakouzi A, Abboud N, et al. A monoclonal antibody to Bacillus anthracis protective antigen defines a neutralizing epitope in domain 1[J]. Infección e inmunidad, 2006, 74(7): 4149-4156.
[7. Domachowske J B, Bonville C A, Rosenberg H F. Animal models for studying respiratory syncytial virus infection and its long term effects on lung function [J]. Revista de enfermedades infecciosas pediátricas, 2004, 23(11): S228-S234.
[8]de Jong R, Nuiten W, Ter Heide A, et al. Adaptación de mediciones de la función pulmonar en tiempo real para estudios de infección por SARS-CoV-2 en hámsters sirios[J]. Virus, 2024, 16(7): 1022.
Contacte con nosotros
Nos comprometemos a hacer que su investigación sea más fácil, precisa y eficaz, y a ayudarle a generar confianza en sus datos Hemos prestado servicios a un gran número de clientes y tenemos una gran experiencia en ofrecer soluciones personalizadas y profesionales de acuerdo con sus necesidades.





