Ver traducción automática
Esta es una traducción automática. Para ver el texto original en inglés haga clic aquí
#Novedades de la industria
¿Qué son las técnicas de biopsia líquida?
¿Qué son las técnicas de biopsia líquida?
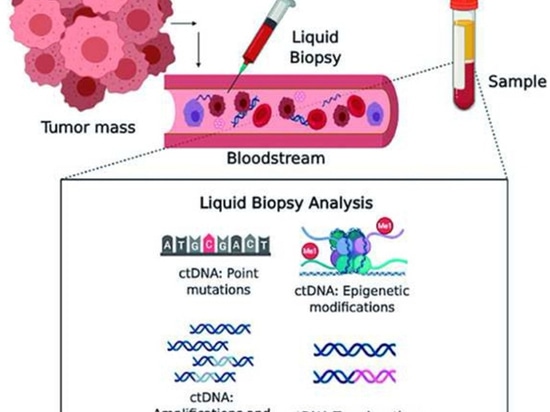
¿Qué es una biopsia líquida?
En la lista de las 10 tecnologías innovadoras de 2015 publicada por la revista MIT Technology Review, la tecnología de la biopsia líquida fue distinguida en la lista.
▲Comparación entre la biopsia tradicional y la biopsia líquida
La biopsia líquida se refiere al análisis y diagnóstico del cáncer y otras enfermedades mediante el análisis de la sangre u otros fluidos corporales como la orina, la saliva, el derrame pleural, el líquido cefalorraquídeo, etc. El fluido corporal del paciente se utiliza principalmente como muestra de biopsia tumoral, y los objetos capturados y detectados incluyen células tumorales circulantes (CTC), ADN tumoral circulante (ctDNA) y exosomas en los fluidos corporales. La biopsia líquida es una de las áreas más candentes de la industria biomédica en los últimos años. En comparación con la biopsia tisular estándar, la biopsia líquida presenta algunas ventajas teóricas: menor traumatismo, reproducibilidad, juicio de eficacia en tiempo real, ajuste dinámico de las decisiones de tratamiento, etc.
▲Tipo de muestra de la biopsia líquida
La aparición de la tecnología de la biopsia líquida marca otro gran paso adelante para la humanidad en el camino hacia la conquista del cáncer. En comparación con la biopsia de tejido tradicional, la biopsia líquida tiene varias ventajas: En primer lugar, la biopsia líquida puede ser un sustituto de las áreas a las que la biopsia de tejido no puede llegar. En segundo lugar, las biopsias de tejidos sólo pueden reflejar la información de la muestra, mientras que las biopsias líquidas pueden detectar el estado general del paciente. Además, las biopsias líquidas detectan principalmente el ADN tumoral circulante (ADNc), que suele viajar desde el tejido tumoral hasta los vasos sanguíneos. En consecuencia, las biopsias líquidas localizan las células cancerosas más rápidamente que si se basan en los síntomas y las imágenes para el diagnóstico. La tecnología de la biopsia líquida es rentable. Gracias a la toma de muestras no invasiva, no sólo puede reducir en gran medida la dificultad del diagnóstico y la atención del cáncer, sino también adelantar el momento del diagnóstico del cáncer y prolongar eficazmente el periodo de supervivencia de los pacientes.
#01
Células tumorales circulantes (CTC) y tumores
1)Las células tumorales circulantes (CTC) se definen como aquellas células cancerosas que abandonan las lesiones tumorales sólidas y entran en el torrente sanguíneo. Las CTC no son los únicos derivados tumorales en la circulación, pero contienen un conjunto de precursores metastásicos que son esenciales para completar la progresión de la enfermedad. Las células tumorales circulantes que entran en la circulación sanguínea contienen el genoma completo, el proteoma y otra información biológica, y tienen el potencial de convertirse en lesiones metastásicas, lo que representa la agresividad de los tumores.
▲Introducción a los componentes de la sangre
Sin embargo, las condiciones técnicas limitan el aislamiento de las CTC vivas, principalmente debido a la dificultad de aislar las CTC en su estado de rareza en comparación con las células sanguíneas. Sin embargo, no faltan las tecnologías de reciente desarrollo que pueden tanto capturar como aislar las CTC y probarlas a nivel molecular para su adecuación a las aplicaciones clínicas. Desde el punto de vista clínico, las CTC han demostrado su valor como biomarcadores predictivos del pronóstico de enfermedades, y se está probando su idoneidad para otras aplicaciones. Desde el punto de vista técnico, suele ser necesario enriquecer las células tumorales circulantes a partir de las células sanguíneas masivas y distinguir las células tumorales malignas de los glóbulos blancos y rojos.
2) En exploraciones anteriores, se ha desarrollado un gran número de técnicas especializadas de aislamiento de CTC que, en esencia, pueden dividirse en dos grandes categorías: ① células que capturan las CTC en función de la expresión de antígenos específicos (selección positiva); ② consumen el conjunto de células no CTC (selección negativa).
Una de las técnicas clásicas basadas en células (selección positiva) para CTC se basa en un procedimiento de dos pasos: el primer paso implica la centrifugación de la muestra para eliminar los componentes plasmáticos, mientras que las CTC se capturan utilizando ferrofluido magnético conjugado con la molécula de adhesión de células epiteliales (EpCAM); En el segundo paso, las CTC putativas se tiñeron e identificaron adicionalmente utilizando un anticuerpo anticitoqueratina, mientras que los glóbulos blancos (WBC) contaminantes se identificaron mediante la tinción CD45. Los avances en la tecnología de secuenciación unicelular también están facilitando el análisis molecular de muestras celulares de CTC individuales poco frecuentes.
3) CTC individuales y grupos de CTC. Un cúmulo de CTC se define como un grupo de dos o más CTC con uniones celulares estables que pasan juntas por la sangre. En comparación con las CTC individuales, los grupos de CTC mostraron perfiles de expresión génica y patrones de diseminación distintos. El análisis del transcriptoma demostró que los grupos de CTC conservaban características epiteliales. Las uniones célula-célula pueden desempeñar un papel clave en la formación y el mantenimiento del sistema circulatorio. En la actualidad, la investigación relacionada con los grupos de CTC también está en pleno desarrollo.
▲ CTC y grupos de CTC
#02
ADN tumoral circulante (ctDNA) y tumor
1)El ctADN suele ser un fragmento de ADN secretado activamente por las células tumorales o liberado a la circulación durante la apoptosis o la necrosis de las células tumorales, con una longitud de 132-145 pb y una vida media corta (generalmente <2 h). El ctADN porta características genéticas derivadas de las células tumorales, como la mutación, la metilación, la amplificación o el reordenamiento de genes, y puede utilizarse como un importante indicador para el cribado de tumores, el diagnóstico complementario, la evaluación de la eficacia del tratamiento y la estratificación del riesgo pronóstico. La biopsia líquida es un método mínimamente invasivo para visualizar la suma de ctDNA en los sitios de los tumores primarios y secundarios. No sólo se puede cuantificar la cantidad de ctADN, sino que también se pueden identificar los cambios genéticos. Se han identificado mutaciones específicas en genes en el plasma de varios tipos de pacientes con cáncer, lo que pone de manifiesto que el ctADN es un posible biomarcador del cáncer. Sin embargo, conseguir concentraciones detectables de ctADN en los fluidos corporales no es trivial, y los fragmentos de ctADN presentan vidas medias cortas.。
▲Consenso de expertos sobre la práctica clínica de la secuenciación de alto rendimiento del ctADN en 2022
El consenso de expertos sobre la práctica clínica de la secuenciación de alto rendimiento de ctDNA en 2022 señaló: Con el rápido desarrollo de la biopsia líquida, es posible utilizar los fluidos corporales para analizar las características moleculares de los pacientes, especialmente el alto rendimiento basado en el ADN tumoral circulante (ctDNA). La tecnología de secuenciación de próxima generación (NGS) se ha utilizado cada vez más en la clínica debido a sus ventajas de ser no invasiva o mínimamente invasiva, el corto tiempo de detección, la capacidad de reflejar la heterogeneidad intratumoral y metastásica, y el seguimiento dinámico de la eficacia terapéutica.
▲ctLos niveles de ADN son generalmente dinámicos y están influenciados por múltiples factores
los niveles de ctADN son generalmente dinámicos y están influenciados por múltiples factores:
a.Factores como el tipo de tejido patológico del tumor, la localización, el estadio y la carga tumoral pueden afectar a la liberación de ctADN. Los niveles de ctADN son generalmente más bajos en pacientes con tumores con menor carga tumoral, localizaciones específicas (por ejemplo, tumores intracraneales) e histologías específicas (por ejemplo, gliomas), y con menores niveles de proliferación, apoptosis y vascularización.
b.Interferencia del ADN de otras numerosas fuentes. Como otras células normales o el ADN derivado de los leucocitos, junto con el ctADN se denomina ADN libre de células (cfADN).
c La información sobre mutaciones genéticas que porta el cfDNA producido por las células hematopoyéticas clonales puede interferir con los resultados del ensayo de ctDNA.
d. El ADNc tiene una vida media corta y los efectos de los fármacos también pueden afectar al contenido de ADNc.
En comparación con las pruebas histológicas, las pruebas de ctADN tienen las ventajas de ser no invasivas o mínimamente invasivas, la toma de muestras repetida y el corto tiempo de recogida, procesamiento e informes de análisis. El ctADN plasmático también ha aumentado la tasa de detección de mutaciones de genes controladores en comparación con la biopsia de tejido sola. Sin embargo, en comparación con las muestras de tejido, el contenido de ctADN en la sangre periférica es menor, lo que es propenso a obtener resultados falsos negativos en las pruebas clínicas. El hecho de no utilizar los leucocitos como control también puede conducir a resultados falsos positivos debido a la variación de la línea germinal o a las mutaciones hematopoyéticas clonales. Además, también hay diferencias en la cantidad de ctADN liberado en la sangre entre diferentes pacientes con tumores o el mismo paciente en diferentes momentos, lo que también aporta dificultades a la detección e interpretación clínica del ctADN.
2 Aplicación del ctADN en el diagnóstico complementario. Los diagnósticos de compañía (CDx) se consideran una herramienta indispensable en la medicina personalizada de los tumores, que requiere que la información proporcionada por los resultados de las pruebas sea suficiente para garantizar la seguridad y la eficacia de los fármacos terapéuticos correspondientes. Pacientes que se benefician de un tratamiento específico. La primera aplicación clínica de la detección de ctADN como CDx fue la detección de mutaciones en el receptor del factor de crecimiento epidérmico (EGFR), que se utilizó principalmente para identificar a los pacientes con CPNM avanzado que podrían beneficiarse de los TKIs del EGFR.
En el estudio ENSURE, el ctDNA detectó las mutaciones EGFR 19del y L858R con una especificidad del 98,2% y una sensibilidad del 76,7%; y los pacientes tratados con erlotinib basándose en los resultados del ctDNA tuvieron una SLP significativamente mejorada en comparación con los pacientes de quimioterapia. Basándose en los resultados de este estudio, la FDA aprobó el primer producto CDx de biopsia líquida, Cobas EGFR Mutation Test v2, en 2016, seguido por la Administración Nacional de Productos Médicos (NMPA) en 2019 para aprobar el lanzamiento nacional de este producto CDx. En el estudio FLAURA, la tasa de respuesta objetiva (ORR) de los pacientes con ADNc T790M positivo a osimertinib fue consistente con la de los pacientes con biopsia tumoral positiva. Esto ha abierto una ola de puntos calientes de investigación en la detección de ctDNA en la enfermedad mínima residual (MRD) y la deficiencia de recombinación homóloga (HRD).
3 Puntos clave de la tecnología de detección de ctDNA NGS. La etapa intermedia del análisis incluye dos pasos: "experimento húmedo" y "experimento seco". el "experimento húmedo" incluye la extracción del ácido nucleico, el diseño y la síntesis del cebador o la sonda, la preparación de la biblioteca, la secuenciación a bordo, etc. La preparación de la biblioteca puede elegir la captura de hibridación o la amplificación. El control de calidad de esta etapa debe establecer los requisitos correspondientes a la concentración de ácido nucleico, la pureza y la distribución de fragmentos en la extracción de ácido nucleico y cumplir con la implementación. El "experimento seco" abarca cada paso del proceso de análisis bioinformático, y el control de calidad de esta etapa debe ser la profundidad mínima de secuenciación, la profundidad media de secuenciación, la uniformidad de la cobertura, el contenido de guanina y citosina (GC), el valor de calidad de la llamada de base, la comparación del valor de calidad y la tasa de on-target, etc., hacer los requisitos correspondientes y cumplirlos. La fase posterior al análisis incluye la interpretación del informe de la prueba, la discusión en el consejo molecular de tumores (MTB) y el asesoramiento genético
Estrategias de construcción de bibliotecas Las estrategias de secuenciación dirigida para la detección de ctADN mediante métodos de NGS se dividen principalmente en dos tipos: NGS basada en captura híbrida (NGS de captura híbrida) y NGS basada en amplificación (NGS de amplificación). El método NGS basado en la captura híbrida es un método en el que la sonda de captura se hibrida con una región específica del genoma para obtener y analizar la secuencia de la región objetivo. Este método tiene muchos pasos de operación, y el proceso es relativamente complicado. Se tarda entre 1 y 2 días en completar la construcción de la biblioteca y pasar al ordenador. Puede detectar mutaciones puntuales, inserciones y deleciones de pequeños fragmentos y variaciones en el número de copias, así como reordenamientos de genes a nivel de ADN, y se pueden encontrar algunas fusiones desconocidas. la sensibilidad de la detección puede alcanzar más del 95%. Las sondas utilizadas en la construcción de la biblioteca del método de captura de la secuencia diana están diseñadas con sondas de ADN y sondas de ARN, principalmente para el enriquecimiento dirigido de la región diana, para asegurar el enriquecimiento completo de la secuencia diana de la muestra, para mejorar la eficiencia del enriquecimiento y la uniformidad de la cobertura, y para reducir eficazmente el coste de la secuenciación. Los enfoques de NGS dirigidos basados en amplicones se basan en múltiples pasos de amplificación por PCR para enriquecer las secuencias objetivo. Durante los experimentos, el tiempo de trabajo real para la preparación de bibliotecas basadas en la amplificación suele ser más corto que el de los métodos de captura híbrida. Independientemente del método utilizado, deben establecerse criterios claros para las bibliotecas elegibles para cada ensayo.
Resumir
La aparición de la biopsia líquida es la mejora del sistema de detección de tumores existente. La biopsia líquida puede detectar rastros de tumores en el cuerpo en una etapa temprana, y es un método importante para la detección temprana de tumores. Además, en comparación con la biopsia tisular tomada directamente del tejido tumoral, el material de la biopsia líquida se deriva de la sangre, lo que es menos invasivo y conveniente para el seguimiento en tiempo real. El efecto positivo es una importante tecnología de diagnóstico y tratamiento de tumores.
referencias
[1]. Consenso de expertos sobre la práctica clínica de la secuenciación de alto rendimiento del ctDNA (edición 2022)
[2].Secuenciación de nueva generación (NGS): una herramienta de oro en la caja de herramientas forense PMID: 27543959
[3].Relevancia clínica del análisis de ADNc en sangre: detección de mutaciones y más allá.PMCID: PMC7852556
[4].Seguimiento de la progresión del cáncer: desde las células tumorales circulantes hasta la metástasis.PMCID: PMC7082968