Ver traducción automática
Esta es una traducción automática. Para ver el texto original en inglés haga clic aquí
#Tendencias de productos
Pasado y presente de los PARPis
Pasado y presente de los PARPis
En 2014, se lanzó el primer inhibidor de PARP Olaparib (Olaparib). Se trata del primer fármaco comercializado bajo el concepto de Letalidad Sintética, que abrió una nueva vía para la terapia dirigida a tumores.
Los inhibidores de PARP y su mecanismo
El nombre completo de los inhibidores de PARP es inhibidores de la poliadenosina difosfato ribosa polimerasa.
En 1922, Calvin Bridges, un genetista que trabajaba en el Laboratorio Morgan de la Universidad de Columbia, descubrió que se producía la muerte de la drosophila cuando se inactivaban mutacionalmente dos genes específicos de la drosophila al mismo tiempo, mientras que la inactivación mutacional en sólo uno de estos dos genes no causaba daños mortales a la drosophila. La llamada "letalidad sintética" significa que para dos genes en una célula, cuando uno de ellos está mutado solo o no funciona, no causará la muerte celular; y cuando ambos están mutados o no pueden expresarse, provocará la muerte celular. Este principio puede lograr la muerte selectiva de las células tumorales sin afectar a las células somáticas normales.
En 2005, dos estudios publicados por Nature al mismo tiempo confirmaron por primera vez que existe un efecto letal sintético entre los inhibidores de PARP y las mutaciones BRCA1/2.
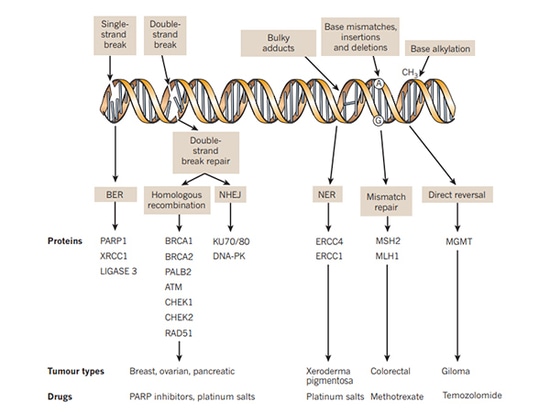
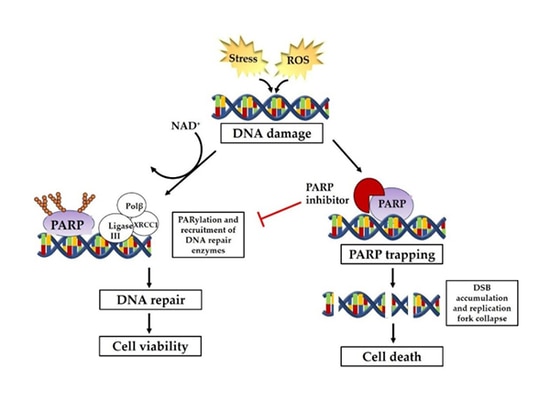
Las vías implicadas en la reparación del ADN incluyen principalmente la reparación de roturas de cadena simple (SSBR) y la reparación de roturas de doble cadena (DSBR). Los mecanismos de reparación incluyen principalmente la recombinación homóloga (HR), la unión de extremos no homólogos (NHEJ), la reparación por escisión de bases (BER), la reparación por escisión de nucleótidos (NER), la reparación de emparejamientos erróneos (MMR) y la síntesis de translesiones, etc. Entre ellas, la reparación de la cadena sencilla del ADN depende de la vía de reparación mediada por PARP. Cuando se daña el ADN monocatenario, PARP se reunirá en el lugar de rotura del ADN monocatenario y se activará, reclutando así una serie de complejos para participar en la reparación del ADN. Los inhibidores de PARP inhiben la actividad de la enzima PARP para impedir que funcione formando polímeros PAR para atraer a las proteínas relacionadas con la reparación del daño en el ADN. La reparación por recombinación homóloga (HRR) es el método de reparación preferido para las roturas de doble cadena del ADN. Los pacientes con deficiencia de reparación por recombinación homóloga (HRD) causada por mutaciones del gen HRR, incluidas las mutaciones BRCA en células cancerosas, mutaciones de la línea germinal, mutaciones somáticas de genes relacionados reparados por recombinación homóloga, inactivación epigenética y muchos otros factores, pierden la función de reparación de roturas de doble cadena del ADN, lo que provoca que no se pueda realizar la reparación tanto de la cadena simple como de la doble cadena de las células cancerosas para lograr la letalidad sintética.
Inhibidores de PARP aprobados
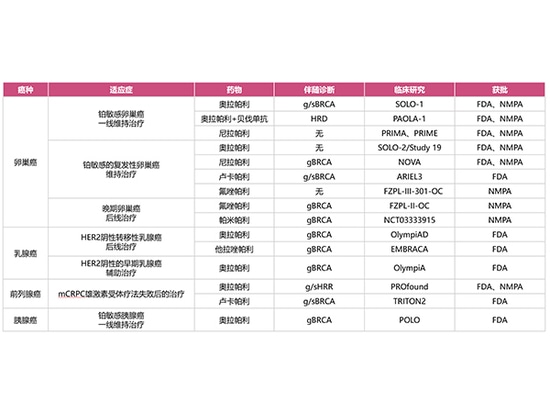
En la actualidad, la FDA estadounidense ha aprobado 4 inhibidores de PARP (Olaparib, Niraparib, Rucaparib y Talazoparib, mientras que la NMPA china ha aprobado 4 inhibidores de PARP (Olaparib, Niraparib, Fluzoparib, Pamiparib), que se han aplicado clínicamente al cáncer de ovario, el cáncer de mama, el cáncer de páncreas y el cáncer de próstata.
Indicaciones aplicables aprobadas por la FDA:
Orapali:
Se utiliza para el tratamiento de mantenimiento de pacientes con cáncer de ovario avanzado con mutación g/s BRCA que alcanzaron RC/RP tras quimioterapia de primera línea basada en platino;
Para el tratamiento de mantenimiento de pacientes con cáncer de ovario recurrente sensible al platino que alcanzaron RC/RP tras quimioterapia de primera línea basada en platino;
Para el tratamiento de mantenimiento combinado con bevacizumab de pacientes con cáncer de ovario avanzado HRD-positivo que lograron RC/RP tras quimioterapia de primera línea basada en platino;
Para el tratamiento adyuvante de pacientes adultas con cáncer de mama precoz de alto riesgo HER2 negativo con mutación gBRCA que hayan recibido quimioterapia neoadyuvante o adyuvante;
Para el tratamiento de pacientes adultas con cáncer de mama metastásico con mutación gBRCA y HER2 negativo que hayan recibido quimioterapia neoadyuvante o adyuvante;
Para el tratamiento de mantenimiento de pacientes con adenocarcinoma pancreático metastásico que no hayan progresado con el régimen de quimioterapia de primera línea basado en platino durante al menos 16 semanas y tengan mutaciones gBRCA;
Para el tratamiento de pacientes adultos con cáncer de próstata metastásico resistente a la castración (CPRCm) con mutaciones en el gen g/s HRR que progresaron tras recibir enzalutamida o abiraterona antes de la terapia madre.
Nirapali
Se utiliza para el tratamiento de mantenimiento de primera línea de pacientes con cáncer de ovario avanzado que han alcanzado RC/RP con quimioterapia de primera línea basada en platino;
Para el tratamiento de mantenimiento de pacientes con cáncer de ovario recurrente sensibles al platino
Lucapali
Se utiliza para el tratamiento de mantenimiento de pacientes con cáncer de ovario recurrente sensible al platino;
Para el tratamiento de pacientes adultos con cáncer de próstata resistente a la castración metastásico (CPRCm) que hayan recibido previamente terapia dirigida al receptor androgénico y quimioterapia con taxanos y que presenten mutaciones del gen BRCA.
Talazoparib
Se utiliza para el tratamiento de pacientes con mutación del gen BRCA, cáncer de mama localmente avanzado o metastásico HER2 negativo.
Indicaciones aplicables aprobadas por el NMPA:
Orapali
Se utiliza para el tratamiento de mantenimiento de pacientes con cáncer de ovario recurrente sensible al platino;
Para el tratamiento de mantenimiento de primera línea de pacientes con cáncer de ovario avanzado con mutación BRCA;
Para el tratamiento de mantenimiento de primera línea combinado con bevacizumab para pacientes con cáncer de ovario avanzado de diagnóstico reciente que hayan recibido remisión completa o remisión parcial tras quimioterapia basada en platino y sean HRD positivas;
Para la monoterapia de pacientes adultos con cáncer de próstata metastásico resistente a la castración portadores de mutaciones BRCA1/2 (germinales y/o somáticas) y progresión de la enfermedad tras un tratamiento previo con nuevos medicamentos hormonales.
Nirapali
Se utiliza para el tratamiento de mantenimiento de pacientes con cáncer de ovario recurrente sensible al platino después de que la quimioterapia con platino consiga la remisión completa o la remisión parcial;
Para el tratamiento de mantenimiento de primera línea de pacientes con cáncer de ovario avanzado que presentan una respuesta completa o parcial a la quimioterapia de primera línea basada en platino.
Fluzoparib
Se utiliza para el tratamiento de pacientes con cáncer de ovario recurrente sensible a platino con mutación gBRCA que han recibido quimioterapia de segunda línea o más;
Para el tratamiento de mantenimiento de pacientes con cáncer de ovario recurrente sensible al platino tras la remisión completa o remisión parcial de la quimioterapia basada en platino.
Pamipali
Se utiliza para el tratamiento de pacientes con cáncer de ovario avanzado, cáncer de trompas de Falopio o cáncer peritoneal primario que hayan recibido al menos dos líneas de quimioterapia y mutación gBRCA.
Indicaciones aplicables retiradas por la FDA:
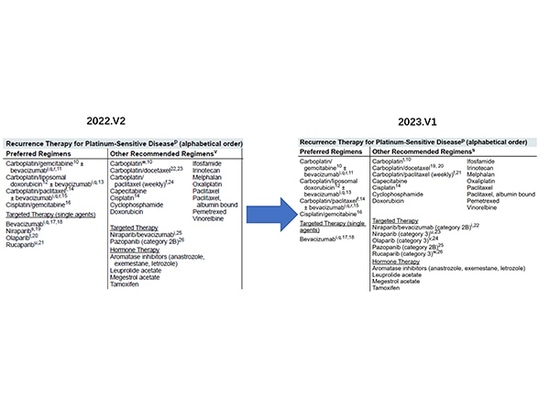
Con la actualización continua de la investigación clínica, los datos clínicos muestran que el riesgo de muerte de las pacientes con cáncer de ovario que utilizan lucaparib, olaparib y niraparib ha aumentado, por lo que la FDA retiró algunas de las indicaciones pertinentes, de las cuales la reducción de las indicaciones para la terapia de mantenimiento de segunda línea por niraparib es la más notable, y las directrices de la NCCN también se han ajustado a tiempo para eliminar la recomendación correspondiente y reducir el nivel de recomendación.
1. En junio de 2022, la FDA retiró el rucaparib para el tratamiento de última línea de pacientes con cáncer de ovario con mutación BRCA.
2. En agosto de 2022, la FDA retiró olaparib para el tratamiento de última línea de pacientes con cáncer de ovario avanzado con mutaciones BRCA.
3. En septiembre de 2022, la FDA retiró niraparib para el tratamiento de última línea de pacientes adultas con mutaciones BRCA, cáncer de ovario epitelial recurrente HRD-positivo y sensible al platino, cáncer de trompa de Falopio o cáncer peritoneal primario.
4. En noviembre de 2022, la FDA retiró algunas indicaciones del tratamiento de mantenimiento con niraparib para pacientes con cáncer de ovario recurrente sensible al platino.
En marzo de 2021, los datos de SG (supervivencia global) de un estudio NOVA en el que se utilizó niraparib como tratamiento de mantenimiento en pacientes con cáncer de ovario recurrente sensible al platino mostraron que, en el caso de las pacientes con mutaciones no BRCA, la mediana de SG en el grupo de niraparib fue de 31,1 meses, en comparación con 36,5 meses en el grupo de control, lo que significa que no hay beneficio para la SG con el tratamiento de mantenimiento con niraparib. En el resultado final de SG del estudio NOVA, la hazard ratio (HR) de SG para pacientes sin mutación BRCA fue de 1,10 (IC 95%: 0,831-1,459).
En septiembre de 2022, la Sociedad Americana de Oncología Clínica (ASCO) lanzó "PARP Inhibitor Ovarian Cancer Management: ASCO Guideline Rapid Recommendation Update", en la que se hacía hincapié en que, en el caso de las pacientes con cáncer de ovario recurrente sin mutación del BRCA, el tratamiento de mantenimiento con niraparib debe sopesarse entre el posible beneficio de la SLP (supervivencia libre de progresión) y la disminución de la SG.
Ahora, con la retirada de las indicaciones parciales de los inhibidores de PARP, el uso clínico de los inhibidores de PARP está relativamente en calma y también hay demanda de una orientación precisa de la medicación.
Resumen
Los inhibidores de PARP son fármacos dirigidos que ejercen efectos antitumorales mediante el efecto "letal sintético" sobre la base del DRH. Su advenimiento ha cambiado el modelo de tratamiento del cáncer de ovario, convirtiendo la terapia de mantenimiento en una parte importante del tratamiento global del cáncer de ovario, lo que supone un hito.
En la práctica clínica, las indicaciones para el uso de inhibidores de PARP deben ser estrictamente comprendidas. Se recomienda detectar rutinariamente las mutaciones del gen BRCA antes de la medicación, y la detección de DRH debe realizarse si las condiciones lo permiten, con el fin de guiar con precisión la medicación clínica y evaluar el pronóstico.
Entre las indicaciones de los inhibidores de PARP, además del cáncer de mama, el cáncer de ovario, el cáncer de trompas de Falopio, etc., el cáncer de próstata, que también es un cáncer reproductivo, también cuenta con un gran entusiasmo de investigación y desarrollo, y la terapia combinada también es un importante punto caliente de investigación. En el futuro, a medida que concluyan más ensayos clínicos, los escenarios de aplicación clínica de los inhibidores de PARP y los marcadores moleculares relacionados serán cada vez más claros.
referencias:
1. Directrices para la aplicación clínica de los inhibidores de PARP en el cáncer de ovario (edición de 2022)
2. Nature. 2012 Jan 18;481(7381):287-94.
3. J Clin Med. 2019 Mar 30;8(4):435.
4. Sitio web oficial de la FDA
5. Sitio web oficial de la NMPA
6. Directrices de la NCCN