#Tendencias de productos
El valor de la aplicación de la metilación del cáncer de pulmón en el diagnóstico temprano del cáncer de pulmón
La perspectiva de la detección de la metilación del cáncer de pulmón.
Según estadísticas de la Organización Mundial de la Salud, el cáncer de pulmón es la principal causa de muerte por cáncer en todo el mundo, con una tasa de incidencia del 11,4 % y una tasa de mortalidad del 18,0 %. En China, el cáncer de pulmón tiene la tasa de incidencia más alta entre los tumores malignos. El adenocarcinoma de pulmón (LUAD) es el subtipo histológico más común de cáncer de pulmón de células no pequeñas (NSCLC), y representa aproximadamente el 40 % de los casos de cáncer de pulmón. La resección quirúrgica del NSCLC en etapa temprana ofrece un buen pronóstico, con una tasa de supervivencia a 5 años del 70-90 % (etapa I), pero la mayoría de los pacientes (alrededor del 75 %) reciben el diagnóstico en una etapa tardía (etapa III/IV) y tienen una baja tasa de supervivencia. Con el desarrollo de tecnologías de secuenciación, se han descubierto patrones anormales de metilación del ADN en varios tumores y se consideran una causa importante de cáncer. La metilación suele estar presente en secuencias de ADN altamente y moderadamente repetitivas y juega un papel clave en la inestabilidad cromosómica. La alta metilación de las regiones promotoras de los genes supresores de tumores a menudo se asocia con el silenciamiento de genes. La metilación del ADN está involucrada en las primeras etapas de la formación de tumores. Además, la metilación del ADN es relativamente estable a lo largo del tiempo y puede detectarse de forma no invasiva en sangre, orina, saliva y otros fluidos corporales. Por lo tanto, se ha desarrollado un número cada vez mayor de biomarcadores de metilación para la detección temprana y el diagnóstico de tumores. Los estudios nacionales[1] han demostrado que la detección de metilación combinada de SHOX2 y RASSF1A en líquido de lavado broncoalveolar tiene una eficiencia de diagnóstico general significativamente mayor para el cáncer de pulmón que el examen citológico y el antígeno carcinoembrionario biomarcador sérico. Otro estudio mostró que cuando los dos genes se detectaron mediante PCR específica de metilación, las tasas de detección de adenocarcinoma de pulmón y carcinoma de células escamosas en individuos con resultados positivos fueron del 66,0 % y el 90,9 %, respectivamente. Esto indica el valor significativo de la detección de la metilación de SHOX2 y RASSF1A en el diagnóstico temprano del cáncer de pulmón.
La función y enfermedades asociadas del gen RASSF1A
La familia de dominios de asociación RAS (RASSF) consta de 10 miembros, desde RASSF1 hasta RASSF10. Estas proteínas se caracterizan por el dominio de asociación RAS (RA), que se puede encontrar en el extremo C-terminal (p. ej., RASSF16, conocida como proteína C-RASSF) o N-terminal (p. ej., RASSF7-10, conocido como N-terminal). proteínas RASSF). RASSF1 y RASSF5 son miembros ampliamente y significativamente estudiados de esta familia de proteínas, mientras que hay pocos datos disponibles sobre otros miembros.
RASSF1A y RASSF1C se expresan ampliamente en tejidos normales y se localizan en microtúbulos, participando en la regulación del crecimiento. Sus papeles en el cáncer son casi opuestos, el primero juega un papel supresor de tumores y el segundo juega un papel crucial en la carcinogénesis. El silenciamiento transcripcional de RASSF1A por la alta metilación altera el equilibrio entre los dos, lo que lleva a la sobreexpresión de RASSF1C y guía su función en el desarrollo del cáncer. Según datos relevantes, la metilación del promotor RASSF1A ocurre con una frecuencia de hasta el 88 % en el cáncer de pulmón, mientras que casi no se metila en el tejido circundante normal. La frecuencia de metilación del promotor RASSF1A alcanza casi el 100 % en el cáncer de pulmón de células pequeñas (SCLC) y el 65 % en el cáncer de pulmón de células no pequeñas (NSCLC).
La función y enfermedades asociadas del gen SHOX2
La proteína SHOX se distribuye principalmente en las extremidades, el corazón, la nariz, los arcos branquiales, el sistema nervioso y la parte media a distal del tubérculo genital embrionario humano. SHOX2 está relativamente cerca de las extremidades. Además, SHOX2 también se expresa en la placoda nasal, el sustrato del sistema nervioso central, los ganglios de la raíz dorsal, el tracto de entrada del corazón, el tercer arco faríngeo y las estructuras derivadas. El gen SHOX regula principalmente el desarrollo de estructuras corporales embrionarias tempranas y el sistema de marcapasos cardíaco. Las mutaciones en el gen SHOX generalmente conducen a la pérdida de expresión y pueden provocar el síndrome de baja estatura.
SHOX2 inhibe la apoptosis y activa la vía NF-kB al aumentar RUNX2 para suprimir la actividad de p53, lo que conduce a la aparición de procesos cancerígenos.
RASSF1A es un factor regulador clave en la vía del hipopótamo y vincula esta vía con las vías de señalización de TNF-α, NF-kB y TGF-β. En cooperación con las citocinas inflamatorias, P53 y K-RAS, la pérdida epigenética de RASSF1A vincula una serie de importantes vías de señalización del cáncer y desempeña un papel importante en la aparición y la metástasis del cáncer. Debido a su compleja relación con ciertos microARN, SHOX2 puede interactuar con las vías Hippo, EMT, RAS/ERK MAPK y PI3K/AKT, que son fundamentales para la tumorigénesis, la metástasis y la aparición de cáncer de pulmón.
SHOX2 puede unirse a receptores de TGF e interactuar con la vía NF-kB, lo que indica una relación de regulación mutua con RASSF1A.[2]
Sensibilidad y especificidad de la metilación de SHOX2 y RASSF1A en estudios clínicos
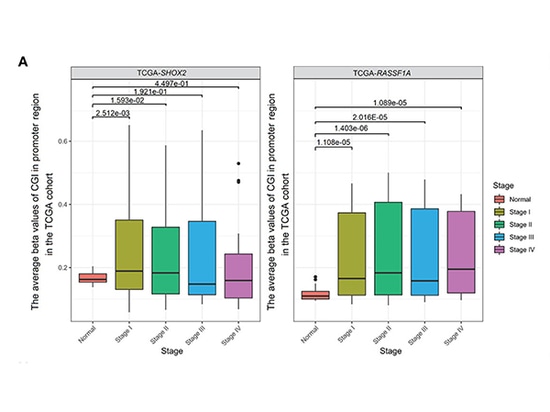
La metilación combinada de los promotores SHOX2 y RASSF1A se determinó en muestras de 54 pacientes con LUAD en etapa temprana y 31 pacientes con nódulos pulmonares benignos en el Hospital Drum Tower de Nanjing. Los resultados mostraron que el nivel de detección de la metilación del promotor SHOX2 en muestras tumorales de pacientes con LUAD fue ligeramente superior al de RASSF1A. Se encontró que la detección de la metilación del promotor SHOX2 o RASSF1A era sensible y específica para el LUAD en etapa temprana, pero la eficiencia diagnóstica de la detección de la metilación de un solo gen no era alta. El potencial diagnóstico de la detección de metilación de promotores combinados para pacientes en etapa 0 aún no está claro. A medida que el estadio de la enfermedad aumentó desde el estadio 0-II o a medida que LUAD progresó de AIS (adenocarcinoma in situ) a MIA (adenocarcinoma mínimamente invasivo) y luego a IPA (adenocarcinoma invasivo), los niveles de metilación del promotor SHOX2 o RASSF1A aumentaron gradualmente. Los pacientes con resultados positivos en la detección de metilación combinada pueden tener tumores que progresan rápidamente y requieren un tratamiento activo. Además, el análisis de la cohorte TCGA mostró que SHOX2 no aumentó significativamente del estadio III al estadio IV. Esto puede indicar que la hipermetilación del promotor SHOX2 es un biomarcador para LUAD en etapa temprana pero no para LUAD en etapa tardía [3].
Comparación de la metilación entre muestras normales y tumorales de los estadios I-IV en la cohorte TCGA
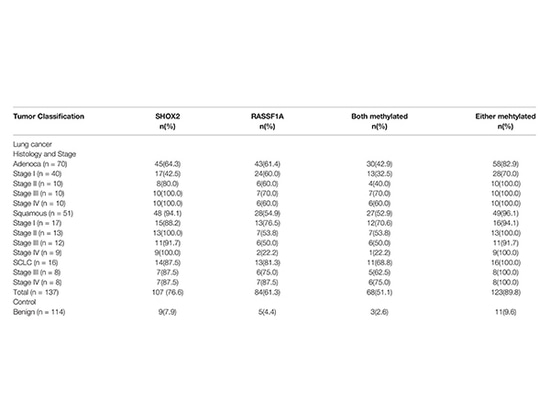
Se detectaron niveles de metilación de SHOX2 y RASSF1A en muestras de resección FFPE de 251 pacientes en el Hospital Tongji, Universidad de Tongji. Entre ellos, 137 casos fueron diagnosticados con cáncer de pulmón, incluidos 70 adenocarcinomas, 51 carcinomas de células escamosas y 16 cánceres de pulmón de células pequeñas. Otros 114 casos fueron enfermedades benignas como controles. Además, se analizaron 17 muestras de biopsias de pacientes con cáncer de pulmón. Para todas las muestras, se analizaron las características clínicas relacionadas con la clasificación histológica y el estadio tumoral confirmado por patología.
Metilación de SHOX2 y RASSF1A en diferentes subtipos histológicos y grupos de estadificación tumoral
Las tasas de detección positiva de SHOX2 y RASSF1A fueron del 100,0 %, 96,1 %, 82,9 % y 89,8 %, respectivamente, en cáncer de pulmón de células pequeñas , carcinoma de células escamosas, adenocarcinoma y todos los cánceres. En el grupo de control, se detectó que 11 de 114 pacientes con enfermedades pulmonares benignas dieron positivo para SHOX2 o RASSF1A, con una especificidad del 90,4 %. La sensibilidad de la detección de SCC fue del 94,1 % para SHOX2 solo. En combinación con RASSF1A, las tasas de detección de adenocarcinoma y cáncer de pulmón de células pequeñas aumentaron del 64,3 % y el 87,5 % al 82,9 % y el 100 %, respectivamente. Solo se observó una menor sensibilidad de SHOX2 en el adenocarcinoma en estadio I. El estudio también encontró que el grado de metilación de SHOX2 estaba relacionado con la estadificación del cáncer de pulmón, aumentando de la etapa I a la IV, mientras que no se observó tal correlación para la metilación de RASSF1A en los casos de cáncer de pulmón. Además, se detectó SHOX2 o RASSF1A altamente metilado no solo en 16 especímenes quirúrgicos sino también en 11 especímenes de biopsia histopatológicamente negativos entre 17 especímenes de biopsia. Esto indica que los biomarcadores de metilación tienen una mayor sensibilidad en comparación con los resultados patológicos y pueden mejorar significativamente la eficiencia del diagnóstico[4].
Potencial de la detección de metilación para el diagnóstico precoz del cáncer de pulmón
Actualmente, el diagnóstico patológico de rutina pertenece en gran medida a la "ciencia empírica" y es muy subjetivo. El diagnóstico patológico (incluido el examen citológico e histopatológico) puede verse gravemente afectado por la calidad de la muestra y el nivel de diagnóstico de los patólogos. Es necesario mejorar y mejorar la sensibilidad y la reproducibilidad de la detección. Los métodos de diagnóstico molecular emergentes son más sensibles y objetivos y pueden superar las deficiencias inherentes del diagnóstico morfológico. Los cambios en la metilación del ADN son uno de los biomarcadores más prometedores para el diagnóstico temprano del cáncer y se han transferido de la investigación científica a las aplicaciones clínicas. Muchos estudios informaron sobre varios biomarcadores de metilación del ADN y confirmaron sus funciones en el diagnóstico del cáncer de pulmón. La detección combinada de metilación de RASSF1A y SHOX2, con su alta sensibilidad y especificidad, puede proporcionar biomarcadores sin precedentes para la detección del cáncer de pulmón y el control de la progresión. Una mayor comprensión de las funciones biológicas de RASSF1A y SHOX2 a través de la investigación y la mejora de sus métodos de detección puede ayudar a utilizarlos mejor en la práctica clínica. Se espera que la aplicación de estos biomarcadores mejore la precisión de la detección de pacientes con cáncer de pulmón, lo que aumentará la tasa de supervivencia a 5 años de los pacientes con cáncer de pulmón y guiará el tratamiento clínico individualizado de manera oportuna.
Referencias:
1. Consenso de expertos chinos sobre el diagnóstico de cáncer de pulmón temprano (Edición 2023)
2 J Cáncer Res Clin Oncol. 2020 junio;146(6):1379-1393
3.Oncol frontal. 2022 28 de junio; 12: 849024.
4.Oncol frontal. 14 de diciembre de 2020; 10: 565780.