#Tendencias de productos
Nuevas dianas terapéuticas para el cáncer epitelial de ovario
El cáncer de ovario representa una amenaza significativa para la salud de las mujeres.
A nivel mundial, se ubica como el octavo tumor maligno más común entre las mujeres y es la neoplasia maligna ginecológica más letal, con la tasa de mortalidad más alta entre los tres principales tumores ginecológicos (cáncer de ovario, cervical y endometrial) [1]. En China, la situación con respecto a la prevención y el tratamiento del cáncer de ovario es igualmente sombría. El cáncer de ovario ocupa el tercer lugar entre los tres principales tumores ginecológicos en términos de incidencia y ha ido en aumento cada año. La tasa de mortalidad también es la más alta entre las neoplasias malignas del aparato reproductor femenino [2]. El cáncer de ovario a menudo se conoce como el "asesino silencioso" porque se encuentra en lo profundo de la pelvis y sus primeros síntomas a menudo se ocultan. En el momento del diagnóstico, el 70 % de los pacientes ya se encuentran en un estadio avanzado con diseminación pélvica y abdominal (estadio III/IV) [3]. Entre los diversos tipos de cáncer de ovario, el carcinoma epitelial es el más común y representa aproximadamente el 80% de los tumores malignos de ovario [4]. Según la clasificación de la OMS de 2014, el cáncer de ovario epitelial se puede clasificar en carcinoma seroso (70-80 %), carcinoma endometrioide (10 %), carcinoma de células claras (10 %), carcinoma mucinoso (3 %) y otros tipos raros. (<5%) [5].
El carcinoma seroso se puede dividir en carcinoma seroso de alto grado (HGSC) y carcinoma seroso de bajo grado (LGSC). HGSC representa aproximadamente el 70% de los casos de cáncer de ovario epitelial, mientras que LGSC representa el 5% [5]. HGSC es el tipo más común de cáncer de ovario y se caracteriza por una fuerte invasividad y mal pronóstico. Alrededor del 70% de los pacientes experimentan recurrencia dentro de los tres años posteriores al tratamiento estándar (cirugía + quimioterapia) y, en última instancia, muchos son incurables debido a la resistencia adquirida a los medicamentos [6]. En los últimos años, el pronóstico de HGSC en pacientes con mutaciones BRCA1/2 ha mejorado significativamente con el uso de inhibidores de PARP. Con la aclaración continua de las características moleculares del cáncer de ovario, el tratamiento se ha desplazado gradualmente hacia una terapia de precisión individualizada, y el desarrollo y la aplicación de fármacos dirigidos han traído nuevas esperanzas y han cambiado el enfoque de tratamiento tradicional.
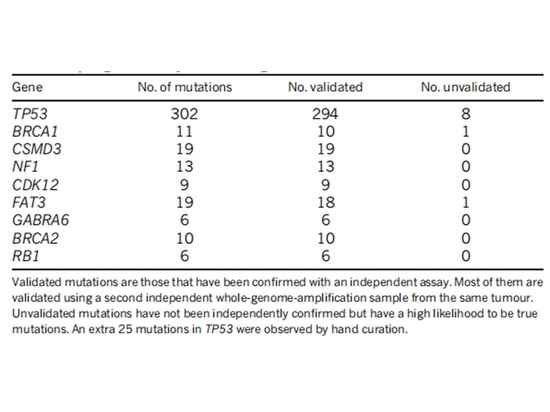
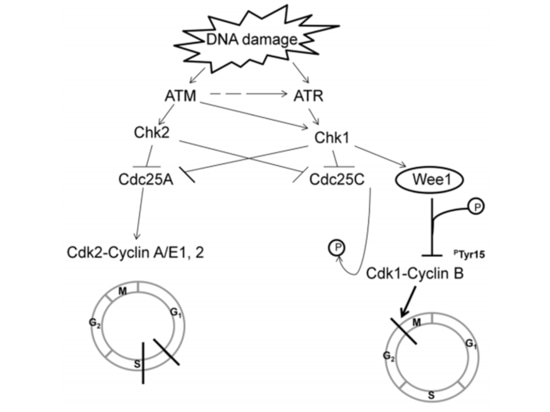
El equipo de investigación de TCGA analizó la expresión del ARNm, la expresión del microARN, la metilación del promotor, el número de copias del ADN y la secuenciación del ADN del exón de los genes codificantes en 489 casos de adenocarcinoma de ovario seroso de alto grado. Descubrieron que casi todas las pacientes con cáncer de ovario seroso de alto grado tenían mutaciones en TP53 (96 %), seguidas de mutaciones en BRCA1/2 (acumuladas en la línea germinal y mutaciones somáticas, que representan el 22 % de los casos) [7] (Figura 1). Después de que ocurren las mutaciones de TP53, se pierde la función de punto de control G1/S de las células tumorales. La quinasa WEE1 puede bloquear la entrada de células en la mitosis en el punto de control G2/M y reparar el ADN dañado para mantener la estabilidad genómica [8] (Figura 2). Si el punto de control de las células G2/M se alivia con un inhibidor de WEE1, el daño del ADN de las células tumorales no se puede reparar, lo que lleva a una "letalidad sintética" [8]. Por lo tanto, los inhibidores de WEE1 se han convertido en posibles fármacos terapéuticos dirigidos para el cáncer de ovario epitelial mutado en TP53. Actualmente, solo adavosertib (AZD1775/MK1775) está bajo ensayo clínico.
Recientemente, los resultados de un ensayo clínico de fase II (NCT02151292), publicados en The Lancet, han atraído la atención mundial. El estudio incluyó a 99 pacientes con cáncer de ovario seroso avanzado, refractario y de alto grado (es decir, pacientes resistentes o refractarios a la quimioterapia basada en platino).
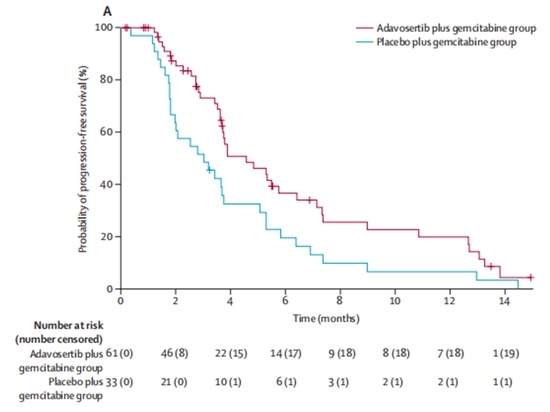
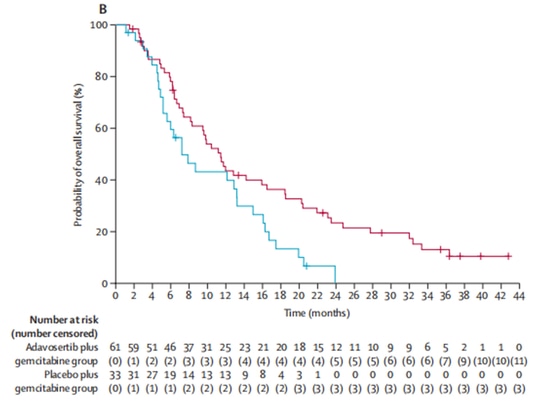
En una proporción de 2:1, el grupo experimental (n=65) recibió el fármaco en investigación inhibidor de Wee1 adavosertib en combinación con tratamiento con gemcitabina, mientras que el grupo de control (n=34) recibió gemcitabina sola. Después de la inscripción, 5 pacientes abandonaron el ensayo clínico por otras razones y no recibieron tratamiento. De los 94 pacientes restantes que recibieron tratamiento, las tasas de respuesta objetiva fueron del 23 % en el grupo experimental y del 6 % en el grupo de control, lo que indica una mejora significativa en las tasas de respuesta objetiva con adavosertib. En términos de supervivencia, adavosertib también prolongó significativamente la mediana de supervivencia libre de progresión (mPFS) de 3,0 meses a 4,6 meses, con una reducción del 45 % en el riesgo de progresión de la enfermedad. La mediana de supervivencia general (mOS) aumentó de 7,2 meses a 11,4 meses, lo que resultó en una extensión promedio de 4,2 meses [9] (Figura 3, Figura 4). El estudio demuestra los beneficios clínicos del inhibidor de Wee1 en combinación con quimioterapia.
Además, un ensayo de fase II doble ciego aleatorizado (NCT01357161) demostró que adavosertib puede mejorar la eficacia terapéutica del cáncer de ovario sensible al platino con mutación p53 cuando se combina con quimioterapia con carboplatino/paclitaxel, mejorando la supervivencia libre de progresión (SLP) (7,9 meses). frente a 7,3 meses). Se observó que adavosertib tiene beneficios clínicos moderados [10]. Otro ensayo clínico de fase II (NCT01164995) indicó que adavosertib mejora la eficacia del carboplatino en el cáncer de ovario mutante p53, con una tasa de respuesta general del 43 %, pero finalmente se desarrolla resistencia [11]. Un estudio clínico de fase II (NCT02272790) mostró los beneficios clínicos de adavosertib en combinación con la terapia con carboplatino; sin embargo, este tratamiento combinado causó con mayor frecuencia toxicidad hematológica en comparación con la monoterapia con carboplatino [12]. Por lo tanto, se necesita investigación futura para optimizar la dosis y el régimen de tratamiento para la combinación de adavosertib y carboplatino.
Los inhibidores de PARP basados en el principio de "letalidad sintética" han demostrado una eficacia significativa en el tratamiento del cáncer de ovario. De manera similar, los inhibidores de WEE1 basados en el mismo principio se han convertido en una opción atractiva para el cáncer de ovario epitelial y han demostrado cierta eficacia en otros tumores sólidos como el cáncer de endometrio, el carcinoma de células escamosas de cabeza y cuello, el cáncer de pulmón de células pequeñas y el cáncer de páncreas. El mecanismo de sensibilidad a los inhibidores de WEE1 en el cáncer de ovario también se está estudiando continuamente. La investigación ha indicado que el estado de activación de mTOR afecta significativamente la sensibilidad de las células cancerosas a la inhibición de WEE1. También se ha informado que el cáncer con defectos H3K36me3 es muy sensible a la inhibición de WEE1. Un equipo dirigido por Pan Chaoyun, Yao Shuzhong y Wang Wei de la Universidad Sun Yat-sen de China descubrió que el gen ODF2L es un factor clave que determina la sensibilidad de las células tumorales epiteliales de ovario a la inhibición dirigida de WEE1. La combinación de apuntar a ODF2L y WEE1 exhibe letalidad sintética [13].
La proteína p53 mutante carece de bolsillos adecuados para la unión del compuesto debido a su superficie lisa, lo que plantea un desafío importante en el desarrollo de fármacos. Esta característica ha convertido a TP53 en uno de los tres principales objetivos "no drogables", junto con RAS y MYC. Sin embargo, actualmente, hay dos medicamentos en el mercado dirigidos a RAS, lo que desafía la noción de su naturaleza "no medicable". Existe la esperanza de que el próximo fármaco basado en el principio de letalidad sintética pueda aprobarse y estar disponible para beneficiar a más pacientes.
Referencias:
[1] CA Cáncer J Clin, 2021.
[2] Revista del Centro Nacional del Cáncer, 2022, 2(1).
[3] NCCN Cáncer de ovario 2023 V1.
[4] Pautas para el diagnóstico y tratamiento del cáncer de ovario (edición de 2022).
[5] Libro blanco sobre el estado del diagnóstico y tratamiento del cáncer de ovario en China (edición de 2022).
[6] Avances en la Aplicación de la Medicina de Precisión en el Adenocarcinoma Seroso de Ovario de alto grado. Fudan Journal of Medical Sciences (edición médica), 1-10.
[7] Nature, 2011, 474(7353): 609-615.
[8] Ciclo celular, 2013, 12(19): 3159-3164.
[9] Lancet, 23 de enero de 2021; 397 (10271): 281-292.
[10] Investigación clínica del cáncer, 2020, 26(18): 4767-4776.
[11] Revista de Oncología Clínica, 2016, 34(36): 4354-4361.
[12] Revista de Oncología Clínica, 2019, 37(15): S5513 [2021-10-24].
[13] Diario de Investigación Clínica, 2023; 133(2): e161544.