Ver traducción automática
Esta es una traducción automática. Para ver el texto original en inglés haga clic aquí
#Novedades de la industria
La relación entre el cáncer de tiroides y el gen RET
La relación entre el cáncer de tiroides y el gen RET
En el número anterior, analizamos la relación entre el gen BRAF y el cáncer de tiroides (véase "La relación entre el cáncer de tiroides y el gen BRAF"). En este número, nos centraremos en el gen RET y desvelaremos los misterios que rodean la relación entre el gen RET y el cáncer de tiroides.
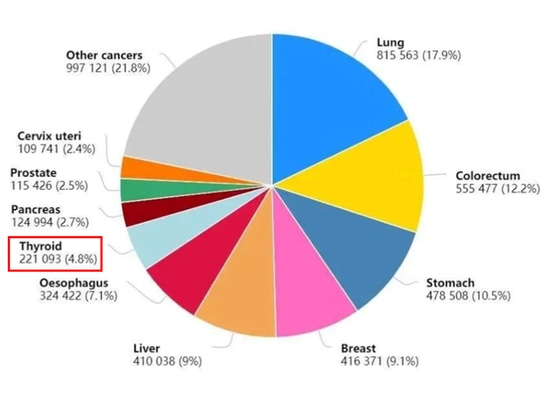
Figura 1: Diez nuevos casos de cáncer en China en 2020
En los últimos años, la incidencia del cáncer de tiroides ha registrado un aumento rápido y sostenido en todo el mundo, incluida China. El número anual de nuevos casos en todo el mundo se aproxima a los 600.000, y los pacientes chinos representan más de un tercio de este total (Figura 1). La proporción entre pacientes de sexo femenino y masculino es de aproximadamente 3:1 [1].
El gen RET, descubierto en 1985, es un oncogén situado en el brazo largo del cromosoma 10 (10q11.2), que abarca aproximadamente 60 kb y consta de 21 exones. El gen RET codifica una proteína tirosina quinasa receptora que regula la proliferación celular, el crecimiento, la diferenciación, la migración y la apoptosis. También desempeña un papel crucial en el desarrollo de órganos y en el proceso de desarrollo del sistema nervioso, además de estar asociado a la producción de esperma masculino [2].
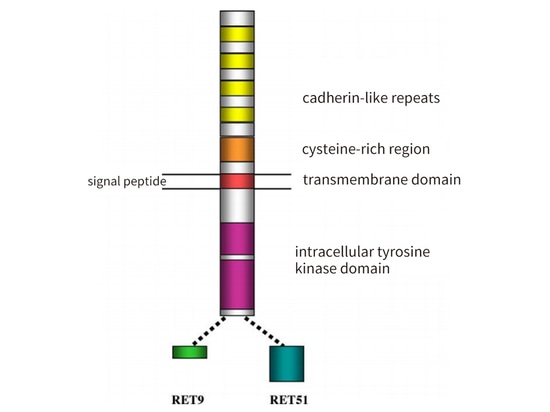
La proteína RET consta de tres dominios: un dominio extracelular con cuatro secuencias repetidas similares a las proteínas de unión al calcio y una región rica en cisteína; un dominio transmembrana; y un dominio tirosina quinasa intracelular. La proteína RET tiene tres subtipos: RET 51 (larga de 51 aminoácidos), RET 43 (media de 43 aminoácidos) y RET 9 (corta de 9 aminoácidos). Presentan diferencias en la regulación temporal y espacial, la localización y el transporte celular, así como en sus funciones biológicas. Entre ellos, RET 51 y RET 9 son los principales subtipos, ambos altamente conservados, pero RET 51 es más eficaz que RET 9 en la promoción de la proliferación celular, la migración y el anclaje [3] (Figura 2).
Figura 2: Representación esquemática de la estructura de la proteína RET
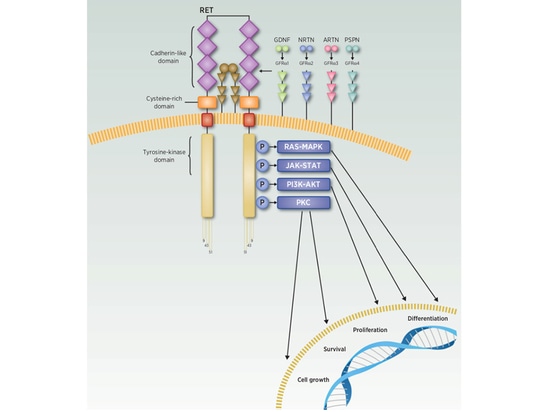
¿Cómo participa el gen RET en la regulación del ciclo de crecimiento celular? ¿Y cómo conduce a la aparición de tumores? La proteína RET interviene en vías de señalización celular como RAS-MAPK, PI3K-AKT, JAK-STAT y PKC, participando en procesos como el crecimiento celular, la proliferación, la diferenciación y la apoptosis a lo largo del ciclo celular. Sin embargo, sólo la proteína RET activada puede activar las vías de señalización descendentes y desempeñar un papel regulador. Las investigaciones actuales indican que la activación de la proteína RET requiere la participación tanto de los ligandos (GFL) de la familia del factor neurotrófico derivado de la línea celular glial (GDNF) como del receptor-α (GFRα) de la familia del GDNF. Existen varios tipos de GFL, entre ellos no sólo el GDNF, sino también la neurturina (NRTN), la artemina (ARTN) y la persefina (PSPN). Cuando los ligandos GDNF, NRTN, ARTN y PSPN se unen a los receptores GFRα1, GFRα2, GFRα3 y GFRα4, respectivamente, el complejo GFLs-GFRα se une a RET, desencadenando su homodimerización, la fosforilación de residuos de tirosina y la subsiguiente transducción de señales intracelulares, participando así en la regulación del ciclo de crecimiento celular [4-5] (Figura 3).
Figura 3 Vía de transducción de señales de RET
1.Cáncer papilar de tiroides (CPT) con mutaciones del gen RET
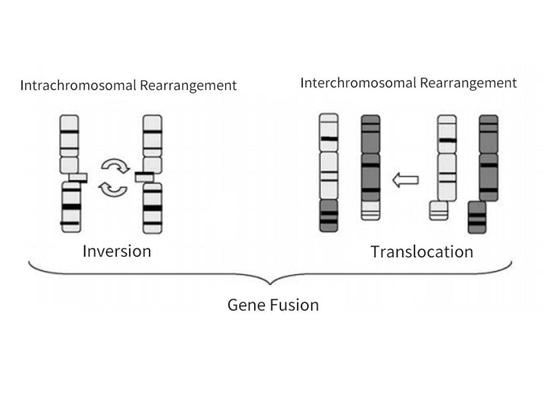
El cáncer de tiroides es el tumor endocrino maligno más frecuente, originado en el epitelio folicular tiroideo o en las células epiteliales parafoliculares (Figura 4). Según el origen y la diferenciación, el cáncer de tiroides puede dividirse en cáncer diferenciado de tiroides (DTC), cáncer medular de tiroides (MTC), cáncer de tiroides poco diferenciado (PDTC) y cáncer anaplásico de tiroides (ATC). Entre ellos, el CDT se divide a su vez en cáncer papilar de tiroides (CPT) y cáncer folicular de tiroides (CFT). Entre todos los tipos histológicos, el PTC es el más común, representando alrededor del 90% de todos los cánceres de tiroides, mientras que el CMT es relativamente raro, representando alrededor del 3%. Los estudios han demostrado que las mutaciones del gen RET se producen con mayor frecuencia en el PTC y el MTC, siendo el PTC el que presenta principalmente reordenamiento RET y el MTC el que presenta principalmente mutaciones RET. En comparación con las mutaciones BRAF más comunes en el PTC, el reordenamiento RET no es muy común en el PTC, representando alrededor del 10% al 20%, y el reordenamiento RET y las mutaciones BRAF son mutuamente excluyentes. Los puntos de rotura del gen RET suelen producirse en el intrón 11, ocasionalmente en los intrones 7 y 10, lo que conduce a la inversión o translocación del extremo 3' del dominio quinasa y el extremo 5' de otros genes asociados. Esta activación de la quinasa RET produce oncoproteínas quiméricas, que en última instancia conducen al desarrollo de tumores [6-8] (Figura 5).
Figura 5: Reordenamiento de RET
Hasta ahora, ha habido más de 35 genes que han formado genes de fusión con RET, entre los cuales CCDC6-RET y NCOA4-RET son los más comunes en el carcinoma papilar de tiroides (CPT), denominados RET/PTC1 y RET/PTC3 respectivamente, representando el 60% y el 30% de los tipos de reordenamiento RET del CPT (Figura 6). La radiación ionizante es un factor común que conduce al reordenamiento RET. Según los informes, la incidencia de reordenamiento RET en pacientes con PTC expuestos a la lluvia radioactiva de Chernobyl o afectados por las bombas atómicas en Japón es del 50% al 80%. Además, es más frecuente en niños que en adultos. Los pacientes jóvenes con cáncer de tiroides con reordenamiento RET suelen presentar invasión extracapsular temprana, metástasis en los ganglios linfáticos y metástasis a distancia, lo que da lugar a un estadio superior. Estudios retrospectivos han demostrado que la tasa de diagnóstico maligno de los nódulos de categoría Bethesda III con reordenamiento RET/PTC es del 60%, sin falsos positivos, lo que indica que el reordenamiento RET/PTC es un marcador altamente específico para el diagnóstico de PTC. El consenso entre los expertos en China recomienda un tratamiento quirúrgico temprano y activo para el PTC con reordenamiento RET [6-8].
Figura 6 Principales tipos de reordenamientos RET (cáncer de tiroides)
2. Variantes del gen RET en el carcinoma medular de tiroides (CMT)
El MTC es un tumor maligno causado por la secreción de calcitonina (Ctn) de las células C parafoliculares. En función de las características genéticas de la enfermedad, el CTM se clasifica en hereditario (20%~25%) y esporádico (75%~80%). Casi todos los casos de CMT hereditario (CMTH) están asociados a mutaciones de la línea germinal en el gen RET, que se heredan de forma autosómica dominante. El 50% de los casos esporádicos de CMT presentan mutaciones somáticas en el gen RET. El HMTC forma parte de la Neoplasia Endocrina Múltiple Tipo 2 (MEN2) y puede clasificarse a su vez en tres subtipos en función de sus características clínicas: MEN2A, MEN2B y Carcinoma Medular de Tiroides Familiar (FMTC). MEN2A es el subtipo más común, representando el 60%~90% de las familias MEN2; MEN2B representa el 5%, con un mayor grado de malignidad; FMTC es el subtipo más indolente de MEN2, manifestándose más tarde en la vida [7, 9].
1. Mutaciones del gen RET y MEN2A
El 95% de los pacientes de MEN2A con mutaciones en el gen RET presentan puntos calientes en seis residuos de cisteína ricos en regiones extracelulares de la proteína RET. Estos residuos se localizan principalmente en los codones 609, 611, 618 y 620 del exón 10, así como en los codones 630 y 634 del exón 11. Los residuos de cisteína en estos sitios son frecuentemente sustituidos por otros aminoácidos, reduciendo la formación intramolecular de enlaces disulfuro. Esto promueve la formación de homodímeros RET a través de enlaces disulfuro intermoleculares, lo que conduce a la activación sostenida de RET en ausencia de ligandos [7, 9, 10] (Figura 7).
2. Mutaciones del gen RET y FMTC
En los pacientes con FMTC, las mutaciones de RET se encuentran no sólo en residuos de cisteína extracelulares, sino también en otros residuos no cisteínicos tanto extracelulares como intracelulares. Algunos ejemplos son Gly533Cys (G533C) en el exón 8 del dominio extracelular, Glu768Asp (E768D), Leu790Phe (L790F), Tyr791Phe (Y791F), Val804Met/Leu (V804M/L), y Ser891Ala (S891A) en los exones 13-15 del dominio quinasa [7, 9, 10] (Figura 7).
3. Mutaciones del gen RET y MEN2B
Los pacientes con MEN2B presentan mutaciones relacionadas con el dominio quinasa del gen RET. El 95% de los pacientes con MEN2B son portadores de la mutación M918T en el exón 16 del gen RET, mientras que menos del 5% son portadores de la mutación A883F en el exón 15. Estas mutaciones pueden alterar la conformación de la proteína, aumentar la afinidad de unión al ATP y reducir la autoinhibición [7, 9, 10] (Figura 7).
Figura 7 Tipos de mutación del gen RET de la familia MEN2
4.Mutaciones del gen RET y carcinoma medular de tiroides (CMT) esporádico
El CMT esporádico implica principalmente mutaciones somáticas en el gen RET. El sitio más común es M918T (aproximadamente 80%), seguido por el segundo sitio de mutación más común, la mutación C634 (alrededor del 15%). Otras mutaciones somáticas poco frecuentes afectan a sitios como A883, C609, C630, entre otros. Los estudios indican que la mutación somática M918T del gen RET está asociada con la invasividad del CMT. Por lo tanto, las directrices recomiendan realizar pruebas para detectar mutaciones somáticas de RET en pacientes con CMT avanzado o en aquellos que estén planificando una terapia selectiva con inhibidores de RET. A pesar de ser una enfermedad esporádica, las investigaciones muestran que entre el 1% y el 7% de los pacientes con CTM esporádico tienen en realidad enfermedades hereditarias. Por lo tanto, las directrices sugieren que los pacientes con CMT esporádico reciban asesoramiento genético y se sometan a pruebas para detectar mutaciones de RET. En el CMT esporádico, las mutaciones RET son mutuamente excluyentes con las mutaciones HRAS y KRAS [7, 9, 10].
5.Estratificación del riesgo por sitios de mutación del gen RET
En la actualidad, se han encontrado más de 100 tipos de mutaciones puntuales, variaciones en el número de copias, inserciones o deleciones en el gen RET asociadas al CMT hereditario. La malignidad de los tumores causados por diferentes sitios de mutación varía, y pueden clasificarse en el grupo de riesgo más alto, el grupo de riesgo alto y el grupo de riesgo moderado (Figura 8). Se emplearán diferentes estrategias preventivas y de tratamiento en función de los distintos grados de riesgo [7, 9, 10].
Figura 8 Sitios de mutación del gen RET y riesgo maligno de cáncer medular de tiroides hereditario
En resumen, la variación del gen RET está estrechamente asociada con el cáncer de tiroides, especialmente en el cáncer papilar de tiroides (CPT) y el cáncer medular de tiroides (CMT). El reordenamiento RET/PTC también puede utilizarse como marcador para el diagnóstico de nódulos tiroideos benignos y malignos. También puede ayudar en el diagnóstico del riesgo hereditario de tiroides y proporcionar una prevención oportuna.
La detección de mutaciones genéticas de cáncer de tiroides de SpaceGen permite evaluar de forma científica y precisa el riesgo de cáncer de tiroides de un individuo y formular un plan de tratamiento personalizado.
Referencias
[1]Últimos datos sobre la carga mundial de cáncer del CIIC 2020.
[2]Cytokine & growth factor reviews,2005,16(4-5): 441-467.
[3]Cytogenet Cell Genet 2001,95:169-76.
[4]Nature reviews Clinical oncology,2018,15(3):151-167.
[5]JMA J, 2020, 3(3): 175-181.
[6]Guías de diagnóstico y tratamiento del cáncer de tiroides (edición 2022)
[7]Consenso de Expertos sobre Pruebas Genéticas RET y Aplicación Clínica del Cáncer de Tiroides (Edición 2021)
[8] Consenso de Expertos de Guangdong sobre Pruebas Genéticas y Aplicación Clínica del Cáncer de Tiroides (Edición 2020)
[9] Consenso de Expertos Chinos sobre Diagnóstico y Tratamiento del Cáncer Medular de Tiroides (Edición 2020)
[10] Directrices del CSCO para el diagnóstico y tratamiento del cáncer medular de tiroides (edición de 2022)