
Ver traducción automática
Esta es una traducción automática. Para ver el texto original en inglés haga clic aquí
#Novedades de la industria
Exploración de la clasificación molecular del cáncer de endometrio para la inmunoterapia en pacientes en estadio avanzado.
Exploración de la clasificación molecular del cáncer de endometrio para la inmunoterapia en pacientes en estadio avanzado.
01
Fondo
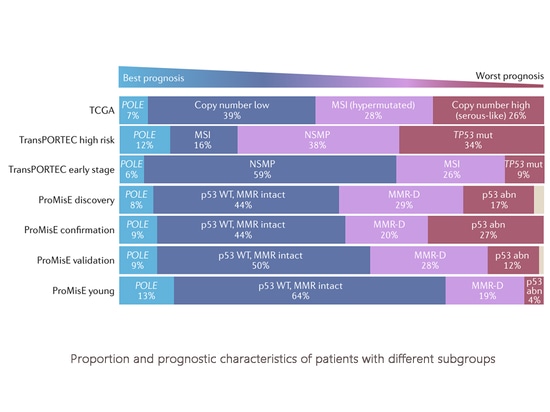
En la última década, un avance significativo en el diagnóstico y tratamiento del cáncer de endometrio ha sido el desarrollo de un sistema de clasificación molecular. Las características moleculares contribuyen a comprender el riesgo de recurrencia y los resultados de supervivencia. El uso de métodos de detección molecular clasifica el cáncer de endometrio en cuatro categorías moleculares distintas: Tipo POLE ultramutado (POLEmut), tipo inestabilidad de microsatélites o deficiente en la reparación de emparejamientos erróneos (MSI-H o MMRd), tipo de perfil molecular inespecífico (NSMP) y tipo p53 anormal (p53abn). Cada categoría corresponde a un pronóstico diferente, siendo generalmente POLEmut la de mejor pronóstico, p53abn la de peor pronóstico y las dos categorías restantes de pronóstico intermedio. La clasificación molecular se ha incorporado a las directrices clínicas (NCCN, CSCO, etc.) y a la última estadificación FIGO. Los métodos de detección de la clasificación molecular incluyen NGS (tipificación exhaustiva), inmunohistoquímica (proteína MMR, proteína p53), secuenciación Sanger (mutaciones de puntos calientes POLE) y análisis de fragmentos (MSI). Independientemente del método utilizado para la detección, cada uno tiene sus propias ventajas.
Proceso de detección de la clasificación molecular del cáncer de endometrio[1]
Proporción y características pronósticas de las pacientes con diferentes subgrupos
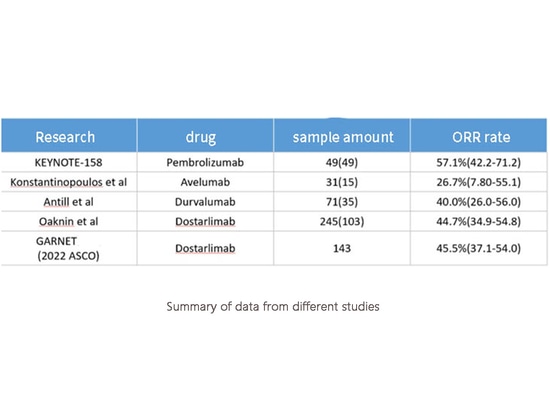
Tanto MMR como MSI son biomarcadores para predecir la eficacia de la inmunoterapia. Por lo tanto, las directrices de la NCCN recomiendan el uso de inhibidores de puntos de control inmunitarios de agente único para el cáncer de endometrio recurrente con deficiencia de reparación de emparejamientos erróneos (MMRd). Sin embargo, la eficacia de la inmunoterapia como agente único para el cáncer de endometrio MMRd no es "notable", con una tasa media de respuesta global (ORR) de sólo el 45%.
Resumen de los datos de diferentes estudios
02
Nueva investigación sobre el tratamiento de primera línea del cáncer de endometrio avanzado y recidivante
Este año en ESMO, los estudios GY018 y RUBY exploraron nuevos enfoques terapéuticos para el tratamiento de primera línea del cáncer de endometrio avanzado o recurrente. Los dos estudios tenían poblaciones de pacientes ligeramente diferentes. El estudio GY018 incluyó a pacientes con cáncer de endometrio en estadio III/IVA mensurable o estadio IVB mensurable/no mensurable o recurrente. En cambio, el estudio RUBY incluyó pacientes con lesiones mensurables en estadios IIIA-IIIC1 en el tratamiento inicial, sin lesiones evaluables en el tratamiento inicial por sarcoma de cáncer, carcinoma de células claras o histología mixta, y estadios IIC2-IV sin lesiones evaluables o cáncer de endometrio recurrente.
En el estudio GY018, a partir del corte del análisis de datos, la mediana del tiempo de seguimiento en la cohorte dMMR (deficiente en reparación de emparejamientos erróneos) fue de 12 meses. La tasa de supervivencia sin progresión (SLP) fue del 74% en el grupo de pembrolizumab en monoterapia, frente al 38% en el grupo placebo. La mediana de la SLP fue no alcanzada (NR) en el grupo de pembrolizumab frente a 7,6 meses en el grupo placebo. La monoterapia con pembrolizumab redujo el riesgo de progresión de la enfermedad y muerte en un 70% (HR 0,30; IC 95%, 0,19-0,48; P<0,001).
En la cohorte pMMR (mismatch repair-proficient) con una mediana de seguimiento de 7,9 meses, la mediana de SLP fue de 13,1 meses frente a 8,7 meses para los grupos de pembrolizumab en monoterapia y placebo, respectivamente. La monoterapia con pembrolizumab redujo el riesgo de progresión de la enfermedad y muerte en un 46% (HR 0,54; IC 95%, 0,41-0,71; P<0,001).
Resultado del estudio GY018[2]
Desde la perspectiva de la investigación RUBY, a partir del análisis de los datos, en la cola dMMR/MSI-H, la tasa de SLP del grupo dostarlimab es del 61,4%, mientras que la del grupo placebo es del 15,7%. Dostarlimab reduce el riesgo de progresión de la enfermedad y muerte de los pacientes en un 72% (HR 0,28; IC 95%, 0,16-0,50; P<0,001); las tasas de SG son del 83,3% frente al 58,7%, y dostarlimab reduce el riesgo de muerte de los pacientes en un 70% (HR 0,30; IC 95%, 0,33-0,70).
En la cola pMMR, las tasas medias de SLP para los dos grupos son del 28,4% frente al 18,8%, y dostarlimab reduce el riesgo de progresión de la enfermedad y muerte de los pacientes en un 24% (CRI 0,76; IC del 95%, 0,59-0,98); las tasas de SG son del 67,7% frente al 55,1%, y dostarlimab reduce el riesgo de muerte de los pacientes en un 27% (CRI 0,73; IC del 95%, 0,52-1,02).
Resultado del estudio RUBY[3]
Resultado del estudio RUBY[3]
Sin embargo, aún existen incertidumbres sobre si los pacientes con otros subtipos también pueden beneficiarse de la inmunoterapia. Por lo tanto, el estudio RUBY llevó a cabo análisis adicionales también en pacientes con otros subtipos. En la primera parte del estudio RUBY, se realizó una clasificación molecular a partir de los resultados de la secuenciación del exoma completo (WES) de todos los pacientes incluidos. El análisis se realizó en 400 de 494 pacientes (400/494). Los resultados mostraron que en el subgrupo de mutación POLE, los pacientes tenían un buen pronóstico, sin recurrencia ni muerte, lo que sugería que podía considerarse la observación. En el subgrupo dMMR/MSI-H, la inmunoterapia mejoró significativamente la supervivencia libre de progresión (SLP) y la supervivencia global (SG), reduciendo el riesgo de recurrencia y muerte en aproximadamente un 70%. Del mismo modo, en el subgrupo de mutación P53, la inmunoterapia también mejoró significativamente la SLP y la SG. En el subgrupo NSMP (perfil molecular no específico), el impacto de la inmunoterapia sobre la SLP y la SG no fue significativo. Por lo tanto, basándonos en los resultados clínicos del estudio RUBY, los pacientes con los subtipos dMMR/MSI-H y P53 en estadio tardío, recurrente y metastásico pueden beneficiarse enormemente de la inmunoterapia, mientras que los beneficios para otros subtipos no son significativos.
SLP según la clasificación molecular[4-5]
SG según clasificación molecular[4-5]
03
Resumen
La inmunoterapia está desempeñando un papel cada vez más importante en el cáncer de endometrio, proporcionando numerosas oportunidades críticas para el tratamiento de pacientes con cáncer de endometrio avanzado. Para las pacientes con cáncer de endometrio MSI-H/dMMR, la inmunoterapia mejora la precisión del tratamiento del cáncer de endometrio. Para las pacientes con cáncer de endometrio MSS/pMMR, la inmunoterapia, en combinación con otros tratamientos, asegura oportunidades de tratamiento para más pacientes y abre nuevas vías de tratamiento. En el futuro, los biomarcadores emergentes, como la TMB, pueden brindar más oportunidades para la inmunoterapia en el cáncer de endometrio. Con la exploración generalizada de la inmunoterapia, la terapia dirigida y otros enfoques en los tumores ginecológicos, la tendencia hacia la precisión y el tratamiento individualizado está remodelando el panorama del diagnóstico y el tratamiento de los tumores ginecológicos. Se prevé que, en un futuro próximo, el diagnóstico y el tratamiento ginecológicos seguirán optimizándose y mejorando, logrando más avances en el diagnóstico y el tratamiento del cáncer de endometrio.
Referencias
[1]Guías de diagnóstico y tratamiento de tumores uterinos de la NCCN 2024.v1
[2]N Engl J Med. 2023 Jun 8;388(23):2159-2170.
[3]N Engl J Med. 2023 Jun 8;388(23):2145-2158.
[4]https://clinicaltrials.gov/ct2/show/NCT03981796.
[5]Mirza MR, et al. 2023 ESMO 740MO.
Declaración: Este artículo es sólo para compartir. Si hay algún problema de derechos de autor, póngase en contacto con nosotros lo antes posible y lo corregiremos lo antes posible. Gracias
![Proceso de detección de la clasificación molecular del cáncer de endometrio[1]](https://img.medicalexpo.es/images_me/projects/images-om/49090-19244879.jpg)
![Resultado del estudio GY018[2]](https://img.medicalexpo.es/images_me/projects/images-om/49090-19244882.jpg)
![Resultado del estudio RUBY[3]](https://img.medicalexpo.es/images_me/projects/images-om/49090-19244884.jpg)
![Resultado del estudio RUBY[3]](https://img.medicalexpo.es/images_me/projects/images-om/49090-19244885.jpg)
![SLP según la clasificación molecular[4-5]](https://img.medicalexpo.es/images_me/projects/images-om/49090-19244886.jpg)
![SG según clasificación molecular[4-5]](https://img.medicalexpo.es/images_me/projects/images-om/49090-19244889.jpg)




